Nanobudbringere til hjernen: Et nyt våben mod sclerose
En udfordring med sygdomme som sclerose, der har udspring i hjernen, er, at det er svært at få medicin ind i hjernen, fordi den er beskyttet af den såkaldte blod-hjernebarriere. Den udfordring prøver forskere nu at tackle ved at udnytte nogle af kroppens egne signalpartikler.
Af Jonas Klejs Hemmingsen, Bradley J. Whitehead, Kenneth A. Howard og Peter Nejsum
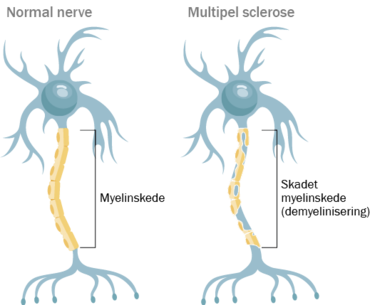
Forestil dig at være ung, men bundet til sengen af en sygdom, der gradvist lammer din krop og dit liv. Sådan ser hverdagen ud for mange med sclerose. Sclerose, eller multipel sclerose (MS), er en sygdom, hvor kroppens eget immunforsvar angriber nervesystemet i hjernen og rygmarven. Det beskadiger myelinskederne, et fedt-isolerende lag på nervefibrene, der normalt beskytter nervecellerne og sikrer hurtig signaloverførsel. Resultatet er neurologiske symptomer, der spænder fra føleforstyrrelser til alvorlige bevægelseshandicap.
Behandlingen af sclerose og andre sygdomme i centralnervesystemet er vanskelig. Det skyldes især, at sygdommen har sit udspring i en del af kroppen, hvor medicinen har svært ved at trænge ind: centralnervesystemet.
Centralnervesystemet består af hjernen og rygmarven. Både hjernen og rygmarven er adskilt fra blodbanen af en specialiseret barriere, blod-hjerne-barrieren. Man kan forestille sig, at den fungerer som en slags grænsekontrol. Fordelen er, at den beskytter hjernen mod skadelige stoffer i blodet ved kun at tillade udvalgte molekyler, typisk små og fedtopløselige såsom oxygen, glukose og visse hormoner at passere. Ulempen ved blod-hjerne-barrierens beskyttende funktion, er, at den udgør en vældig forhindring, hvis vi gerne vil sende hjælp ind i centralnervesystemet. I praksis betyder det, at de fleste lægemidler ikke kan passere blod-hjerne-barrieren.
En naturlig løsning fra kroppens egne celler
Når nu de fleste lægemidler bliver afvist ved blod-hjerne-barrieren, melder spørgsmålet sig: findes der overhovedet en vej ind i hjernen for medicin beregnet til at behandle sygdomme, der er lokaliseret netop der?
Et muligt svar kommer fra kroppen selv. I de senere år er forskere nemlig begyndt at interessere sig for en særlig type signalpartikler, som stort set alle kroppens celler udsender: ekstracellulære vesikler. Tidligere blev de betragtet som biologisk affald, men det billede har ændret sig markant over de seneste to årtier. I dag ved man, at ekstracellulære vesikler spiller en aktiv rolle i kommunikationen mellem celler. De kan indeholde RNA, proteiner og fedtsyrer, og fungerer dermed som små målrettede signalpakker.
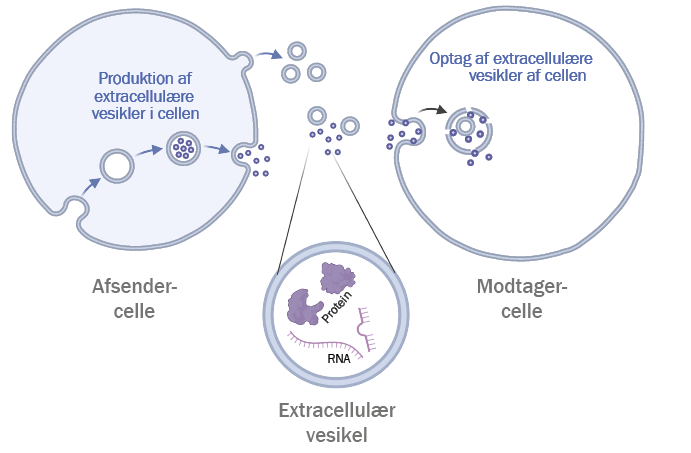
Celler kan sende signaler til hinanden ved hjælp af ekstracellulære vesikler, små naturlige blærer, der indeholder biologiske signalmolekyler som RNA og proteiner. Figuren viser, hvordan en afsendercelle danner og udskiller vesikler, som derefter optages af en modtagercelle. Overordnet er der to måder, cellen producerer ekstracellulære vesikler (som kaldes henholdsvis mikrovesikler og exosomer). I laboratoriet kan vi som udgangspunkt ikke skelne mellem dem, men vi ved, at de dannes på to forskellige måder. Normalt er exosomerne dog mindre end mikrovesiklerne.
Mikrovesikler dannes ved direkte afsnøring fra cellens plasmamembran og er som regel mellem 50-1000 nanometer (øverst på figuren til venstre). Exosomer er 30-150 nanometer og dannes ved ”indfoldning” (indvaginering) i plasmamembranen, som fører til dannelsen af små indsnørede blærer kaldet endosomer. I disse endosomer fortsætter indfoldningen af membranen, som fører til dannelsen af flere vesikler.
Når endosomet er fyldt med vesikler, kaldes det et “multivesikulært endosom”. Disse kan fusionere med cellens plasmamembran, hvorfor vesiklerne frigives og nu betegnes som exosomer. Begge typer betegnes altså som ekstracellulære vesikler, og de kan medbringe en last af signalmolekyler som vist på forstørrelsen.
Ekstracellulære vesikler, eller blot vesikler, er typisk 30-1000 nanometer store og findes blandt andet i blodet, rygmarvsvæsken (cerebrospinalvæsken) og urinen. En vesikel er en slags afsnøret blære. Det, der gør dem særligt interessante i behandlingssammenhænge, er, at de stammer fra kroppens egne celler og derfor ofte ikke er skadelige for kroppen.
Faktisk har studier vist, at ekstracellulære vesikler kan modvirke inflammation. Nok så interessant har flere studier vist, at ekstracellulære vesikler i nogle tilfælde kan krydse blod-hjerne-barrieren, hvilket de færreste lægemidler formår.
Feltet er endnu ungt, men flere og flere forskningsgrupper verden over undersøger ekstracellulære vesiklers terapeutiske potentiale. Der forskes især i at anvende dem til kræftbehandling, men også til autoimmune sygdomme såvel som neurodegenerative sygdomme. Og selvom vi stadig befinder os på et stadium, hvor der endnu ikke er nogen godkendte behandlinger ved brug af ekstracellulære vesikler, så er der flere kliniske studier på mennesker undervejs, dog ingen med fokus på centralnervesystemet. Men flere studier i dyr har vist, at ekstracellulære vesikler kan bruges til at levere både RNA og proteiner til centralnervesystemet.
Derfor betragter forskere i stigende grad ekstracellulære vesikler som biologiske nanotransportører, der på sigt kan bruges til målrettet levering af lægemidler til kroppen. I vores projekt forsøger vi netop at forfine og videreudvikle denne strategi i forhold til behandling af sclerose.
Hvordan får man medicin ind i vesiklerne?
Før en teknologi til sygdomsbehandling baseret på brug af ekstracellulære vesikler er moden til brug i den kliniske medicin, er der en række teknologiske og biologiske udfordringer, der skal løses. En af de mest grundlæggende barrierer er ekstracellulære vesiklers struktur: De består af en dobbelt fosforlipidmembran, der omslutter et indre rum med proteiner, RNA og andre biomolekyler. Denne struktur minder om cellemembraner og gør vesikler stabile, men også vanskelige at manipulere uden at forstyrre deres funktion.
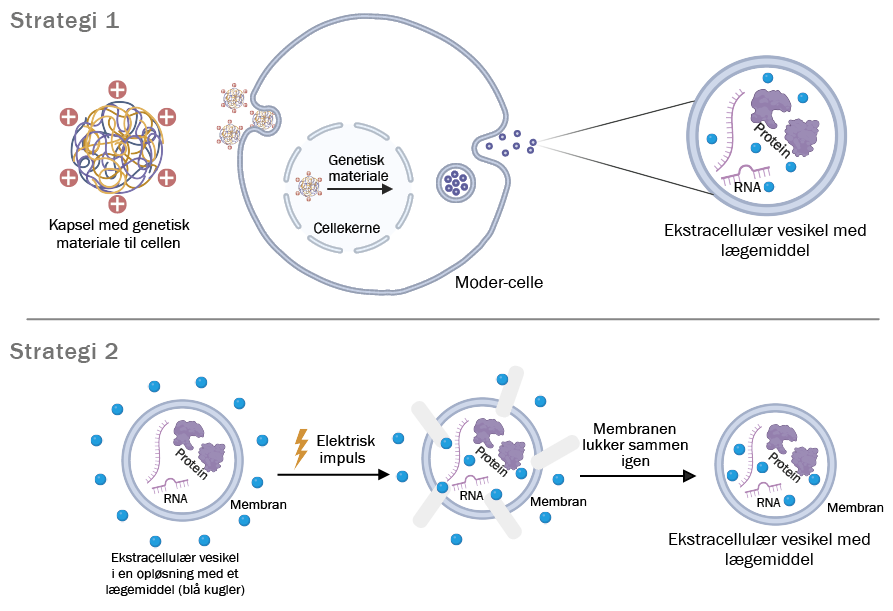
Figuren viser to overordnede strategier til at pakke lægemidler ind i ekstracellulære vesikler: Øverst: genetisk materiale overføres til en moder-celle. Cellen modtager et signal om at producere ekstracellulære vesikler med indhold af det ønskede lægemiddel.
Nederst: efter dannelse af ekstracellulære vesikler placeres de i en opløsning med et lægemiddel og udsættes for elektriske impulser. Disse impulser skaber midlertidige porer i membranen, så lægemidlet kan trænge ind. Når impulsen ophører, lukker membranen sig igen.
Den første udfordring er derfor, hvordan man får det ønskede lægemiddel ind i den ekstracellulære vesikel uden at beskadige den. Overordnet set er der to veje at gå. Lægemidlet kan enten bringes ind i de ekstracellulære vesikler før eller efter, de er dannet.
I det første tilfælde kan man modificere cellen, så den simpelthen producerer vesikler med det ønskede indhold. Det kan gøres ved at tilføre genetisk materiale eller give cellerne bestemte signalstoffer, der får dem til at ændre deres aktivitet. Når cellerne så naturligt udskiller ekstracellulære vesikler, indeholder de allerede lægemidlet. Fordelen ved den tilgang er, at vesiklerne bevarer deres normale struktur og funktion. Ulempen er, at det er svært at kontrollere præcis, hvor meget medicin hver enkelt vesikel kommer til at indeholde.
I den anden metode forsøger man at pakke lægemidlet i de ekstracellulære vesikler, efter de er produceret fra cellerne. Her bruger man blandt andet elektriske impulser til midlertidigt at åbne vesikelmembranen, eller man blander vesiklerne med høje koncentrationer af lægemidlet i håb om, at det passivt trænger ind. Denne metode giver bedre kontrol, men risikoen er, at vesiklernes struktur ændres, og de mister deres evne til at finde det rigtige mål i kroppen.
Flere store udfordringer
Selv hvis det lykkes at pakke et lægemiddel ind i ekstracellulære vesikler, opstår den næste udfordring. For at lægemidlet skal virke, skal vesiklen ikke blot nå frem til det ønskede organ (hjernen), den skal også genkendes og optages af de rigtige celler, altså de syge celler i dette tilfælde. I dag findes der eksperimentelle tilgange – godt nok kun på forsøgsstadiet – hvor man udstyrer vesiklernes overflade med særlige signalmolekyler, der genkendes af de syge celler.
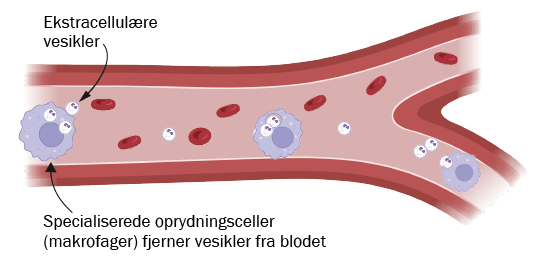
Denne fremgangsmåde skal blandt andet imødekomme et af de største problemer, nemlig cirkulationstiden af ekstracellulære vesikler i blodet. Kroppen har nemlig specialiserede celler, især i lever og milt, der overvåger og fjerner partikler fra blodet. Derfor vil mange af de medicinbærende vesikler blive fjernet, før de når frem til deres mål.
Figuren viser princippet i vores strategi til at forlænge cirkulationstiden af ekstracellulære vesikler. Normalt fjernes ekstracellulære vesikler i blodbanen hurtigt af specialiserede oprydningsceller (såkaldte makrofager), især i leveren og milten (øverst). Kroppens mest udbredte transportprotein albumin har en lang levetid i blodet sammenlignet med vesikler. Det er især albumins interaktion med andre proteiner, der kan “redde” dem fra at blive nedbrudt i makrofagerne. Ved at dekorere overfladen af ekstracellulære vesikler med albumin kan vi udnytte denne egenskab til at forlænge de ekstracellulære vesiklers cirkulationstid i blodet (nederst).
Om albumin
Albumin er det mest udbredte protein i blodets plasma (blodets flydende del), her udgør albumin omkring 50-65% af det totale proteinindhold. Det produceres i leveren og har mange vigtige funktioner i kroppen. Albumins vigtigste funktion er at opretholde det osmotiske tryk i blodet, altså at holde væske inde i blodbanen. Derudover fungerer det som et transportprotein for en lang række stoffer, herunder hormoner, fedtsyrer og mange lægemidler.
Albumin har en lang halveringstid i blodet (cirka 19 dage), mens andre proteiner, som koagulationsfaktorer, kan variere fra 3 timer til 60 timer. Albumins lange halveringstid er med til at gøre dette protein særligt interessant at udnytte i lægemiddeludvikling, hvor lang cirkulationstid kan være en fordel.
Endelig er der en mere lavpraktisk udfordring: produktion i stor skala. I et laboratorie er det relativt enkelt at fremstille ekstracellulære vesikler. Men hvis de skal anvendes i medicinske sammenhænge, kræver det store mængder rene vesikler med samme egenskaber mellem hvert produktionsparti. Det gør det til en meget mere kompliceret fremstillingsproces.
Der arbejdes derfor intenst med at standardisere metoder til produktion og karakterisering af ekstracellulære vesikler. Det er nødvendigt, hvis teknologien skal bevæge sig fra at være eksperimentelt lovende til at blive anvendt i praksis.
Transportprotein kan være nøglen til supervesikler
Målet med vores forskningsprojekt er at udvikle en ny generation af ekstracellulære vesikler, en slags supervesikler, der både kan overleve længe i blodbanen og samtidig finde vej ind i hjernen uden at bliver opdaget og fjernet undervejs.
Til at producere store mængder ekstracellulære vesikler vil vi bruge en type stamceller kaldet mesenkymale stamceller. Disse celler er robuste, nemme at dyrke og har vist sig velegnede til at danne ekstracellulære vesikler med naturligt forekommende antiinflammatoriske egenskaber.
Men selve nøglen i vores strategi er, at vi kobler vesiklerne til albumin, som er kroppens mest udbredte transportprotein. Albumin er et naturligt forekommende protein i blodet som binder og transporterer mange forskellige stoffer, som fedtsyrer, hormoner og lægemidler.
Albumin genkendes af immunsystemet som en del af kroppen selv. Når vesiklerne er bundet til albumin, bliver de derfor i mindre grad opslugt af de specialiserede celler i lever og milt. Det betyder, at de forbliver længere i blodbanen og har større sandsynlighed for at nå frem til målet.
Desuden har albumin en naturlig evne til at trænge ind i visse væv, særligt sygt eller beskadiget væv. Det gælder også i centralnervesystemet, hvor man i sygdomstilstande, også i sclerose, ser en ændret blod-hjerne-barriere. Det er derfor sandsynligt, at vesikler bundet til albumin i højere grad kan slippe gennem og nå ind i centralnervesystemet, hvor der er brug for dem.
Ved at kombinere ekstracellulære vesikler og albumin forsøger vi altså at skabe en biologisk enhed, der både overlever længere, cirkulerer bredere og måske i højere grad kan nå ind i hjernen.
Hvad kan det betyde for patienten?
Hvis vores strategi lykkes, kan det bane vej for en ny generation af behandlinger mod sygdomme i hjernen. Behandlinger, der er mere præcise, har færre bivirkninger og faktisk krydser blod-hjerne-barrieren og dermed når frem til de syge celler.
Vores primære mål er sclerose, hvor der i dag findes flere lægemidler, men hvor en stor del af dem virker bredt på immunsystemet og derfor kan medføre alvorlige bivirkninger.
Hvis man i stedet kan levere behandlingen direkte til de betændte områder i hjernen, bliver det muligt at dæmpe sygdommen lokalt og skånsomt. På sigt håber vi, at teknologien også kan bruges til andre neurologiske sygdomme, hvor blod-hjerne-barrieren udgør en betydelig barriere for effektiv behandling. ♦
Om multipel sclerose og behandling i dag
Multipel sclerose (MS, også kaldet dissemineret sclerose) er en kronisk autoimmun sygdom, hvor immunsystemet angriber nervecellernes beskyttende myelinskede i centralnervesystemet. Det fører til betændelse, arvæv og gradvis funktionsnedsættelse. Sygdommen rammer typisk unge voksne, især kvinder, og Danmark er blandt de lande med flest tilfælde. Omkring 18.000 danskere lever med MS, og hvert år diagnosticeres 400-600 nye patienter.
Sygdommen viser sig ofte med attakker, pludselige symptomer, som synsforstyrrelser, føleforstyrrelser eller lammelser, dog i varierende grad. Der findes tre hovedtyper: attakvis, sekundær progressiv og primær progressiv multipel sclerose.
Sclerose er uhelbredelig, men behandlingen kan dæmpe attakker og forsinke udviklingen. Ved akut attak behandles der med højdosis methylprednisolon. Til at forsinke udviklingen bruges sygdoms-modificerende behandling (DMT), der i første linje er præparater med lav bivirkningsprofil og anden linje med mere potente, men også bivirkningstunge midler.