Kemiske udfordringer ved CO2 - fangst
Fangst af CO2 direkte fra luften og fra røggasser bliver et vigtigt værktøj til at nedbringe atmosfærens indhold af CO2 i fremtiden. Effektiviteten af de materialer – såkaldte sorbenter – som CO2 skal binde sig til og efterfølgende frigives fra igen, er helt afgørende for mulighederne i denne teknologi. Derfor arbejder kemikere hårdt på at udvikle nye og bedre sorbenter.
Af Aleksa Petrovic og Anders Grundtvig Utzon
Før den industrielle revolution var koncentrationen af CO2 i atmosfæren omkring 0,028 % (280 ppm) – i dag er den 0,042% (420 ppm) og stigende. Hvis vi vil undgå, at den høje koncentration af CO2 får den globale temperatur til at stige mere end 1,5 - 2 °C, må vi have denne udvikling vendt. På sigt er det derfor nødvendigt at indfange CO2 direkte fra atmosfæren. Selvom koncentrationen af CO2 er den højeste nogensinde, udgør CO2 som allerede nævnt ikke nogen stor andel af atmosfæren. Faktisk er kun 1 ud af 2400 molekyler i luften CO2, hvilket kan få CO2-fangst fra atmosfæren – på fagsproget kaldet Direct Air Capture (DAC) – til at syne som en proces, der kan sammenlignes med at finde en nål i en høstak.
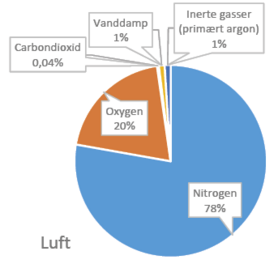
Direct Air Capture er en samlebetegnelse for processer, der sigter på at opsamle CO2 fra atmosfæren så effektivt som muligt. I praksis eksponerer man luft for specialiserede materialer, kaldet sorbenter, som selektivt kan binde sig til CO2 og dermed adskille det fra luftens øvrige komponenter som nitrogen, oxygen, argon, mv. Når materialet har indsamlet en tilstrækkelig stor mængde CO2, kan CO2’en frigives på en kontrolleret måde ved at varme materialet op, hvilket samtidig gør materialet klar til en ny indsamlingscyklus. Den frigivne CO2 kan derefter lagres i for eksempel underjordiske CO2-lagre eller anvendes i den kemiske industri.
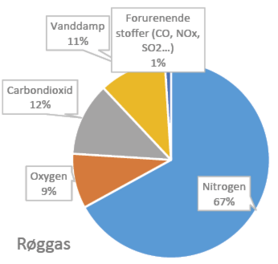
En beslægtet strategi for CO2-fangst kaldes Post Combustion Capture (PCC), som går ud på at fange CO2 fra punktkilder, dvs. hvor den produceres, før den når op i atmosfæren. Herved reducerer man altså emissionerne. Eksempelvis kan man fange CO2 fra røggasser, der ellers var blevet udledt i atmosfæren. Da koncentrationen af CO2 er meget højere fra punktkilder end i atmosfæren, er det billigere og mere gennemførligt med kendte teknologier.
Energiomkostninger ved CO2-fangst
Figuren viser sammensætningen af henholdsvis atmosfærisk luft og røggas. Termodynamikkens love dikterer, at det i udgangspunktet er mere energikrævende at adskille CO2 fra en fortyndet kilde (såsom luft) sammenlignet med en koncentreret kilde (som røggas). De nøjagtige værdier for energiomkostningerne afhænger af en række forskellige faktorer, men groft sagt kræver det minimum 20 kJ/mol at adskille CO2 fra luft og 7 kJ/mol fra røggas.
I praksis er energiomkostningerne dog langt højere for begge processer. Det kræver f.eks. enorme mængder energi at frigive CO2 igen fra sorbenterne efter fangsten – for et system til Post Combustion Capture kræves i størrelsesordenen 80-100 kJ/mol. Denne høje værdi skyldes dels den høje bindingsenergi mellem CO2- og sorbentmolekylerne, og dels vands varmekapacitet.
Varmekapacitet er et udtryk for, hvor meget energi, der kræves for at hæve temperaturen af et stof. For eksempel kræver det 4,19 kJ at hæve temperaturen på 1 kg vand med 1°C, mens olivenolie kun kræver 1,97 kJ. Den mest udbredte sorbentblanding brugt i Post Combustion Capture består af 30% (w/w) monoethanolamin (MEA) og 70% vand, hvorfor det meste af energien til at frigive CO2 går til at bringe det vandige opløsningsmiddel til kogetemperaturen.
Kemien i CO2-fangst
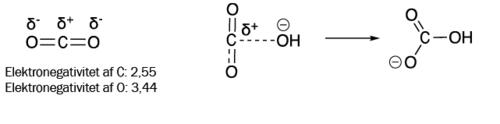
De fleste sorbenter fanger CO2 via en mekanisme, der kan sammenlignes med tiltrækningen mellem modsatrettede poler på en magnet. Et CO2 –molekyle har en lineær struktur, hvor carbonatomet er placeret midt mellem to oxygenatomer (figur 2). Da carbon er mindre elektronegativt end oxygen, kommer carbonatomet i CO2 i elektronunderskud og bliver dermed delvis positivt ladet. Sorbenter er typisk basiske materialer, der indeholder et elektronrigt atom, som bærer en delvis eller fuld negativ ladning. Når et CO2 -molekyle og et sorbent-molekyle nærmer sig hinanden, binder det elektronrige atom i sorbenten sig til det elektronfattige atom i CO2 . Det er i det væsentlige på denne måde, at sorbenter “fanger” CO2.
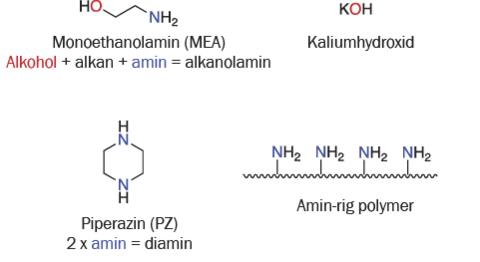
Sorbenter kan enten være væsker eller faste stoffer og anvendes ofte i en vandig opløsning eller aflejres på et porøst, fast stof. De mest udbredte sorbenter til Post Combustion Capture er vandige opløsninger af alkanolaminer og diaminer (figur 3). Til Direct Air Capture er det mere almindeligt at bruge vandige opløsninger af alkalimetalhydroxider (for eksempel KOH eller NaOH) eller porøse faste materialer, der indeholder en høj densitet af aminogrupper.
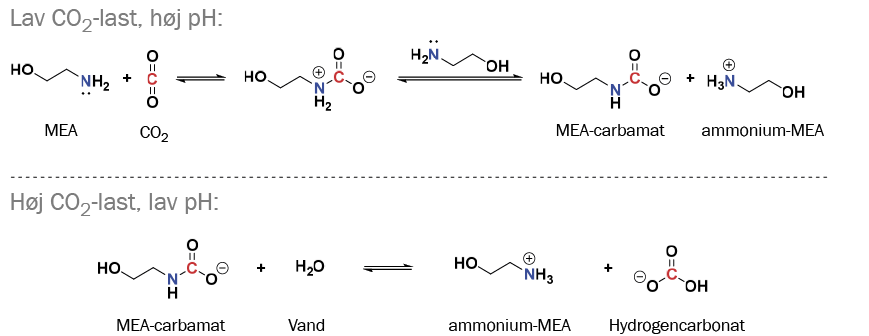
Reaktionen mellem vandig monoethanolamin (MEA) og CO2 er den mest udbredte kemiske reaktion i forbindelse med Post Combustion Capture (figur 4). I denne reaktion danner det elektronrige nitrogenatom i MEA en binding til det elektronfattige carbonatom i CO2. Produktet af denne reaktion er kendt som et carbamat. "MEA-carbamatet" kan derefter reagere med vand, hvilket giver ammonium-MEA og hydrogencarbonat.
Reaktionen kan vendes ved at opvarme opløsningen til 115 °C. Opvarmningen svækker tiltrækningskræfterne mellem CO2 og sorbenten, hvilket frigiver CO2. Derved regenereres MEA samtidig til en ny cyklus.
Kemikernes udfordringer
Vores opgave som kemikere er nu at designe og syntetisere nye og bedre sorbenter samt at demonstrere, at disse kan fange CO2 i laboratorieforsøg. For at være egnet som sorbent skal et materiale hurtigt og effektivt opfange CO2 samtidig med, at energiforbruget til at frigive CO2 og regenerere materialet skal minimeres. Derudover skal materialet være billigt, være muligt at masseproducere og have en lang levetid under de barske forhold, som det kan blive budt i den daglige drift. Desuden skal sorbent-materialet designes specifikt til opgaven – altså om det skal bruges til Direct Air Capture eller Post Combustion Capture.
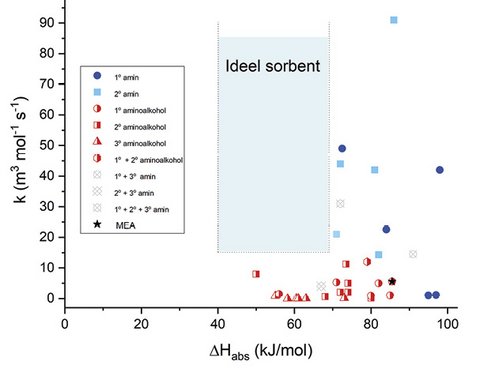
Uanset, om CO2-kilden er luft eller røggas, er det en stor udfordring for kemikere at designe et sorbent, der opfanger CO2 hurtigt og samtidig forbruger en minimal mængde energi under regenerering. Det skyldes, at de fleste sorbenter, der hurtigt opfanger CO2, også binder CO2 meget kraftigt, hvilket betyder at det kræver tilsvarende mere energi at frigive CO2 igen. Kemikere forsøger derfor at identificere den “perfekte” sorbent, der fanger CO2 hurtigt, men som ikke binder det for stærkt (figur 5).
5. Figuren viser, hvordan forskellige sorbenter placerer sig i et plot baseret på deres bindingsstyrke til CO2 (1.-aksen) og den hastighed, hvormed de opfanger CO2 (2.-aksen). Værdierne for hastighed er i høj grad en funktion af mange parametre og skal blot forstås som en omtrent værdi. Selvom plottet giver et simplificeret billede, tjener det som en rå guide til, hvad kemikere stræber efter, når de designer nye sorbenter. Illustration: Eugenio Gandolfo.
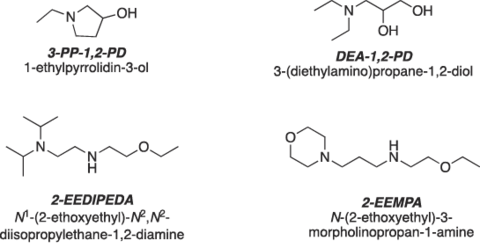
I denne jagt anvendes grundlæggende kemiske principper kombineret med computermodellering til at styre designet af mere effektive sorbenter, der balancerer energiforbruget ved regenerering og fangsthastigheden samt andre vigtige egenskaber. På den måde har kemikere blandt andre identificeret fire lovende forbindelser som kandidater til næste generation af sorbenter (figur 6).
Alle disse materialer er designet til at minimere omkostningerne og maksimere CO2-opsamlingseffektiviteten. For eksempel er den ene af disse sorbenter, 2-EEDIPEDA, en væske, der kan laves ud fra billige udgangsmaterialer og regenereres ved kun 87 °C (sammenlignet med 115 °C for MEA). Disse egenskaber gør dette materiale til en lovende kandidat til Post Combustion Capture.
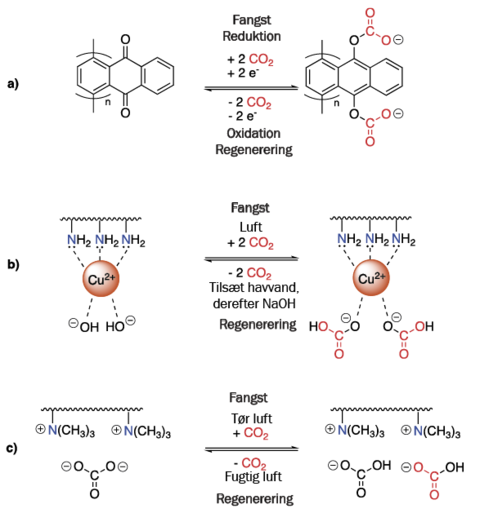
En alternativ tilgang til at håndtere energiforbruget forbundet med regenerering er at udvikle sorbenter, der kan regenereres på anden måde end ved at varme det op. Det kan for eksempel være ved hjælp af redoxprocesser, pH-variationer, trykvariationer eller ændringer i luftens fugtighed (figur 7).
Den største faldgrube ved disse teknologier er, at de er relativt dyre i forhold til opvarmning og derudover er relativt vanskelige at skalere op. Men alle disse teknologier er stadig i deres vorden, og der er et stort potentiale for at videreudvikle dem.
7. Figuren viser indfangnings- / regenereringscyklusserne for tre teknologier, der ikke skal varmes op for at regenerere:
a) regenerering ved oxidationsreaktion;
b) regenerering ved tilsætning af havvand og NaOH;
c) regenerering ved udsættelse for fugtig luft.
Mål: Fang 1 gigaton CO2 årligt
Ifølge det Internationale Klimapanel IPCC er det afgørende at fange mindst 1 gigaton CO2 årligt gennem den kombinerede udnyttelse af Direct Air Capture og Post Combusion Capture. Men i dag er CO2-opsamlingsteknologier ikke så avancerede eller effektive, som de skal være for at kunne have en væsentlig global indflydelse. Så skal vi nå i mål med at fange 1 gigaton CO2 årligt, kræver det udvikling af ny teknologi, og det haster.
Som det er fremgået af denne artikel, er det udvikling af nye og bedre sorbenter, der sætter grænsen for, hvor langt vi kan komme – og hvor hurtigt vi kan nå i mål – med Direct Air Capture og Post Combustion Capture. Derfor arbejder vi kemikere hårdt på at designe og teste den næste generation af sorbenter. ♦