Historien om historien om celledeling – og hvad der sker, når det går galt
Inden for de seneste 70 år er vi gået fra ikke at have den fjerneste idé om, hvordan cellerne i vores krop deler sig, til i dag at kunne manipulere ved så godt som alle cellefunktioner. Lektor Lotte Bjergbæk tager os med på en rejse gennem nogle af de store kvantespring i vores forståelse af fundamentet under selve vores eksistens.
Af Kristian Sjøgren, videnskabsjournalist. ksjoegren@gmail.com
Den fjerde oktober 1951 døde en ung afroamerikansk kvinde på Johns Hopkins Hospital i Baltimore, USA, efter kort tids sygdom. Hun havde livmoderkræft, som havde spredt sig i den unge kvindes krop. Henrietta Lacks blev ikke mere end 31 år gammel.
Henrietta Lacks’ korte liv havde været hårdt. Som teenager havde hun delt værelse med sin fætter, der gjorde hende gravid i en alder af blot 14 år. I alt endte de to med at få fem børn sammen, hvoraf den ene var en udviklingshæmmet kvinde. Fætteren, som hun senere hen giftede sig med, havde dog mere end vanskeligt ved at holde sig fra andre kvinder, og det betød, at han flere gange hev kønssygdomme med hjem i ægtesengen, herunder gonorré og formentlig også HPV, som endte med at lede til livmoderkræft og tage livet af Henrietta Lacks.
Historien om Henrietta Lacks handler dog meget lidt om, hvad der skete, mens hun var i live, men derimod om hvad der skete, efter hun døde. Den unge kvinde kunne ellers meget nemt være forsvundet ud af historiebøgerne, men sådan skulle det ikke gå. Langt fra. Efter Henrietta Lacks døde, udtog læger nemlig et stykke af den kræftramte kvindes livmoder, hvorfra de isolerede nogle celler. Disse celler viste sig at være udødelige og har de seneste 72 år været benyttet i titusindvis af laboratorieforsøg som en af de mest benyttede cellelinjer i verden.
På baggrund af de forsøg, der er blevet lavet med Henrietta Lacks’ celler, er forskere blevet klogere på blandt andet, hvordan celler fungerer, og hvad der går galt, når vi udvikler kræft. Cellerne er også blevet benyttet i tusindvis af forsøg med medicin mod en lang række sygdomme. Henrietta Lacks blev uvidende til en af de vigtigste personer i medicinsk historie.
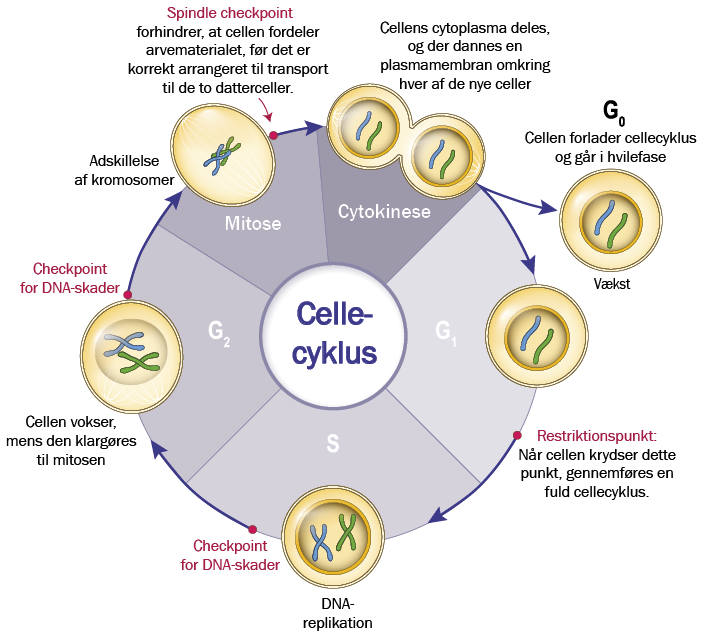
Et par år efter Henrietta Lacks’ død blev DNA for første gang identificeret, og verden blev gjort opmærksom på, at hele livet har sit udspring i en dobbelt helix af to DNA-strenge, der snor sig om hinanden. I 1950’erne vidste man dog ingenting om cellecyklus, ud over at cellerne skal gennem en celledeling, for at én celle kan blive til to, men ellers var alt andet et mysterium.
Der skulle gå 30 år, før forskere for alvor blev klogere på, hvad der regulerer celledeling, hvordan cellen sikrer, at DNA’et bliver korrekt delt i datterceller, og hvad alt det har af betydning for vores forståelse af, hvorfor cellerne fra Henrietta Lacks er udødelige, og hvorfor smitte med HPV endte med at blive hendes død.
»Frem til Henrietta Lacks’ død havde forskere i mange år forsøgt at dyrke humane celler uden for kroppen, men det var ikke lykkedes, fordi cellerne altid endte med at dø efter noget tid. Forskerne dengang tænkte velsagtens, at det heller ikke ville lykkes med disse celler, men det viste sig, at de voksede som ukrudt. Ud fra det opstod den første udødelige cellelinje, HeLa-celler, som vi stadig i dag benytter over alt i verden,« forklarer lektor Lotte Bjergbæk fra Institut for Molekylærbiologi og Genetik ved Aarhus Universitet.
Cykliner
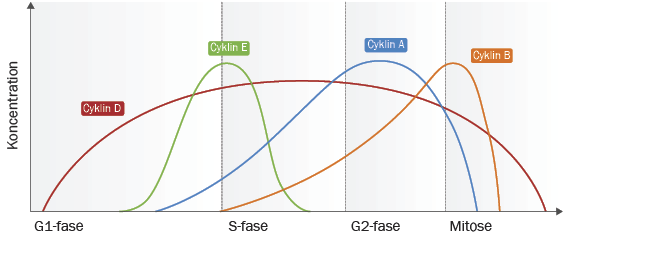
Cykliner er proteiner, som kommer og går i gennem cellens cyklus. Figuren øverst viser, hvordan hver fase af cellecyklus har sine specifikke cykliner – dog er de cykliner, der på figuren kaldes Cyklin D, til stede gennem det meste af cellens cyklus.
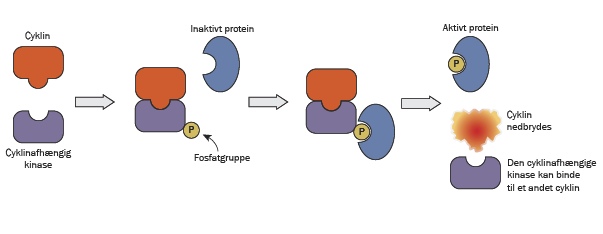
Cyklinerne danner par med en cyklinafhængig kinase (figuren nederst), som katalyserer påhæftning af fosfatgrupper på proteiner eller enzymer i cellen. Dette kan ændre proteinets aktivitet eller eventuelt fjerne den helt. De cyklinafhængige kinaser kan kun sætte fosfatenheder på andre proteiner, når de samarbejder med et cyklin. Proteiner, som modificeres af cyklinafhængige kinaser, spiller alle afgørende roller for cellens gang gennem cellecyklus.
Proteiner kontrollerer cellecyklus
Det næste kvantespring i forståelsen af cellecyklus kom fra to forskere, der i 1980’erne havde hver deres tilgang til forskningsområdet. Paul Nurse studerede celledeling i gærceller, mens Tim Hunt gjorde det samme i æg fra søpindsvin. Tim Hunt var den første forsker til at opdage, at der i løbet af cellecyklus sker noget med koncentrationen af et bestemt protein inde i cellerne. I hans forsøg kom og gik proteinet med regelmæssige intervaller i løbet af cyklus og det så ud til at være vigtigt for at styre hele processen. Opdagelsen var et vindue ind til en helt ny verden.
»Tim Hunt var den første til at opdage de proteiner, som vi i dag kender som cykliner, og som er helt nødvendige for at regulere alle de cellulære processer under cellecyklus, så cellen kan komme gennem de nødvendige faser for at blive delt i to med den korrekte mængde arvemateriale i hver. Det er en meget nøjagtig proces, der kræver stram kontrol og præcision, og det står blandt andet cyklinerne for,« forklarer Lotte Bjergbæk.
Tim Hunt beskrev sin opdagelse og sendte den videnskabelige artikel til et tidsskrift, der, som proceduren foreskriver, sendte artiklen videre til gennemlæsning hos nogle af verdens førende eksperter på området. Derfor havnede den ikke underligt på skrivebordet hos Paul Nurse, der på daværende tidspunkt også var med helt fremme i celleforskningen. Paul Nurse har nok kløet sig i hovedbunden, for ved et rent tilfælde pegede Tim Hunts opdagelse på præcis det samme, som han kort tid forinden selv havde fundet ud af, men ikke havde publiceret endnu.
Paul Nurse havde i sin forskning i gærceller undersøgt, hvorfor nogle gærceller bliver abnormt store eller små, og han konkluderede, at det måtte skyldes en fejl i cellecyklus. I arbejdet var det på samme tid som Tim Hunts opdagelse lykkedes Paul Nurse at identificere forskellige kontrolgener for regulering af cellecyklus. Disse gener viste sig at lave en type af proteiner, som hedder cyklin-afhængige kinaser, der opererer i par med cykliner og altså er lige så vigtige som cykliner for regulering af cellecyklus.
»De erkendelser, som de to herrer kom frem til i løbet af 1980’erne, modtog de Nobelprisen for, og det er i dag lærebogsstof på alle uddannelser, som har med forståelsen af levende celler at gøre,« fortæller Lotte Bjergbæk.
Proteiner tager vare på cellerne
Tim Hunt og Paul Nurse fik dog ikke Nobelprisen for sig selv, men måtte dele den med Lee Hartwell, der dog ikke var så interesseret i at forstå cellecyklus, men derimod interesserede sig for, hvad der sker, når DNA bliver ødelagt af for eksempel stråling. Lee Hartwells idé var, at der ved alvorlige DNA-skader, som kan have betydning for levedygtigheden af dattercellerne, måtte være nogle cellulære mekanismer på plads for ikke bare at opdage skaderne, men faktisk også at bremse cellecyklus, så cellen ikke deler sig, når den er for ødelagt.
Forskningen i Lee Hartwells laboratorium ledte til opdagelsen af det, som vi i dag kender som checkpoint-proteiner, der er i stand til at opdage skader og bremse cellecyklus, hvis der er for mange skader på arvematerialet. Checkpoint-proteiner spiller blandt andet en helt central rolle i at bremse celledeling, så kræft ikke udvikler sig.
»Checkpoint-proteinerne hører til den gruppe af proteiner, som vi kalder for caretaker-proteiner, der sørger for, at cellen har det godt i forbindelse med celledeling ved enten at opdage skader eller reparere dem, når det er nødvendigt. Min egen forskning er i et caretaker-protein, som hos mennesker hedder Blooms-protein, og som er interessant, fordi det er med til at sikre, at cellerne ikke udvikler sig til kræftceller. Det vil også sige, at personer med mutationer i Blooms-proteinet meget ofte udvikler kræft meget tidligt i livet,« fortæller Lotte Bjergbæk.
Ofte er det sådan, at mutationer i bestemte caretaker-proteiner leder til specifikke former for kræft. Den nok mest velkendte er mutationer der medfører ændringer i BRCA-proteiner, som ofte er involveret ved udvikling af brystkræft.
Mutationer i Blooms-proteiner kan dog lede til udvikling af mange forskellige typer af kræft, fordi proteinet spiller en rolle i mange forskellige celletyper. Derudover har Lotte Bjergbæks forskning vist, at hvis man indsætter Blooms-proteinet i gærceller, kan proteinet overtage funktionen af gærcellens pendant, Blooms SGS. Det peger på, at Blooms-proteinet er universelt og har stor betydning for regulering af cellecyklus i praktisk talt alt levende på Jorden.
Celler har behov for at kunne begå selvmord
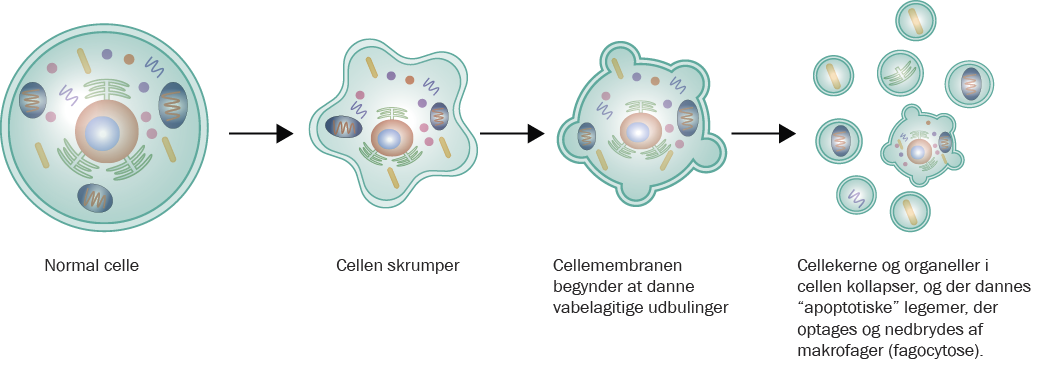
Når de cellulære kontrolmekanismer opdager fejl i enten en celles DNA eller i cellecyklus, har de i store træk to muligheder for at gøre noget ved det. Enten kan cellerne forsøge at udbedre skaden, eller cellerne kan tage livet af sig selv i et cellulært selvmord for at undgå, at skader passerer ned gennem generationer af celler.
Cellulært selvmord kaldes for apoptose, og den mekanisme blev opdaget af postdoc Howard Horvitz, der i 1974 studerede celler i den gennemsigtige orm Caenorhabditis elegans. Det interessante ved C. elegans er, at det er muligt at tælle alle cellerne i ormen, og Howard Horvitz kunne se, at selvom der opstod 1.090 celler undervejs i ormens udvikling, indeholdt den færdigudviklede orm kun 959 celler. Nogle af cellerne måtte altså være døde af sig selv på et eller andet tidspunkt under udviklingen.
Opdagelsen af apoptose var endnu et gennembrud i forståelsen af cellecyklus og celleliv. Den programmerede celledød er ikke bare relevant for små gennemsigtige orme, men også for blandt os mennesker under fosterudviklingen. Fungerer apoptosen ikke, dør cellerne mellem vores fingre og tæer nemlig ikke under fosterudviklingen, og så bliver vi født med svømmehud.
»Apoptose er også vigtigt i livet, fordi den programmerede celledød blandt andet tager sig af gamle celler, der har akkumuleret mange skader på DNA’et. Celler kan klare omkring 60 celledelinger, før de skal dø, og apoptose er en af måderne at komme af med disse gamle celler, der ellers er i risiko for at udvikle sig til kræftceller. Kemoterapi fungerer blandt andet ved at lave mange skader i kræftceller, så programmet for celledød bliver iværksat,« forklarer Lotte Bjergbæk.
P53: Et protein med mange funktioner
P53 er et tumorsuppressor-protein, der spiller en afgørende rolle i reguleringen af cellevækst og celledød. P53 er kodet af TP53-genet og er en af de mest studerede proteiner i forbindelse med kræftforskning.
P53 fungerer som en "celle-vogter", der overvåger cellens DNA og reagerer på skader og mutationer. Hvis cellen opdager skade eller mutationer i DNA'et, aktiveres p53, hvilket fører til flere forskellige responsveje, der kan regulere cellevækst og celledød.
Nogle af funktionerne af p53 inkluderer:
Celledød: P53 kan aktivere apoptose, som er en proces, hvor cellen bevidst går i stykker og dør. Dette er en måde, hvorpå kroppen kan fjerne celler, der har skader på deres DNA.
DNA-reparation: P53 kan også regulere reparationsprocesser, der reparerer skader på DNA'et, hvilket hjælper med at bevare integriteten af cellens genetiske information.
Cellecyklus: P53 kan bremse cellevækst og cellecyklus, hvilket giver cellen tid til at reparere skaderne eller i nogle tilfælde føre til celledød.
Angiogenese: P53 kan også regulere angiogenese, hvilket vil sige dannelsen af nye blodkar i kroppen, som er afgørende for vækst og spredning af tumorer.
Immunitet: P53 kan også påvirke immunsystemet og beskytte mod virusinfektioner.
Funktionen af p53 kan påvirkes af flere faktorer, herunder miljømæssige faktorer som stråling og kemikalier og genetiske faktorer som mutationer i TP53-genet. Mutationer i TP53-genet kan føre til en reduktion i p53-funktionen, hvilket kan øge risikoen for kræft og andre sygdomme. P53 er derfor en vigtig spiller i kroppens forsvar mod kræft, og der er mange aktuelle behandlingsmuligheder rettet mod at genoprette eller øge p53-funktionen i kræftceller.
Derfor kan HeLa-celler ikke dø
Og så er vi tilbage ved Henrietta Lacks. I løbet af 1980’erne identificerede forskere det protein, som regulerer apoptosen. Proteinet hedder p53 og hører til kategorien af såkaldte tumorsuppressorgener, der modvirker udvikling af kræft. Det vil også sige, at mutationer i genet for p53 ofte er associeret med udvikling af kræft.
I undersøgelserne af Henrietta Lacks og hendes kræftceller fandt forskerne ud af, at hun havde været inficeret med HPV, og netop HPV fungerer på den måde, at virus sætter et stykke af sit eget arvemateriale ind i værtscellerne. Dette stykke arvemateriale udtrykker et protein, som nedbryder P53, hvorved cellerne får problemer med at styre cellecyklus og apoptose. Kræft er ikke sjældent udfaldet af denne manglende kontrol, hvorfor vaccinering mod HPV i dag er en del af børnevaccinationsprogrammet.
Den massive forskning i HeLa-cellerne har også belyst, hvorfor Henrietta Lacks’ celler er fortsat med at leve her 70 år efter hendes død.
Normalt, når celler deler sig, bliver der fjernet et lille stykke af enden af arvematerialet, og det betyder, at celler kun kan dele sig et vist antal gange, før det ikke kan lade sig gøre at dele sig mere, uden at det går ud over essentielle dele af arvematerialet. Denne del af arvematerialet hedder telomerer, og under fosterudviklingen sørger proteinet telomerase for hele tiden at forlænge telomererne, så cellerne kan fortsætte med at dele sig uden bagkant. Telomerasen bliver dog slukket i cellerne efter fødslen, men i HeLa-cellerne er telomerasen igen aktiveret af mutationer, hvilket betyder, at arvematerialet bliver forlænget igen og igen, og at cellerne dermed aldrig dør på grund af aldring.
Det er ikke så sært, at forskere har lagt betydeligt arbejde i at forstå telomerer og telomerase som et mål i jagten på udødelighed. Det har de også gjort i cellerne fra Henrietta Lacks.
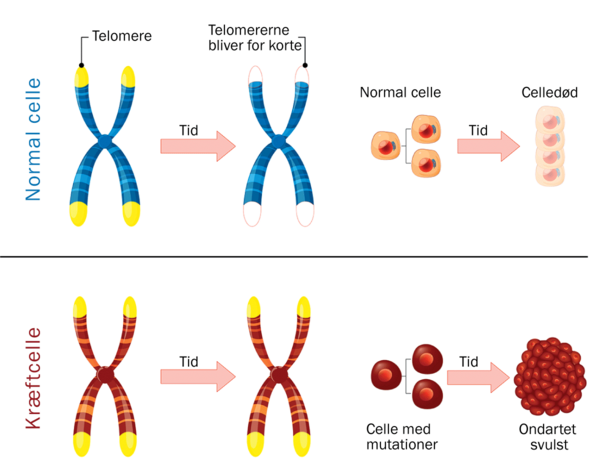
»Der kom til at gå omkring 50 år, fra Henrietta Lacks døde, til vi med hjælp fra blandt andet hendes celler havde fået kortlagt de primære mekanismer bag celledeling, cellecykluskontrol, tumorsuppressorgener, caretaker-gener og apoptose,« siger Lotte Bjergbæk.
Hun uddyber, at rejsen ikke er slut endnu, og over alt i verden forsøger forskere nu at finde ud af, hvad der sker i celler under fysiologiske forhold inden i kroppen.
»Når vi traditionelt har studeret disse processer, har vi gjort det ved at udsætte celler for en masse kemikalier eller stråling og så set, hvordan cellerne forsøger at reparere på sig selv eller begå selvmord. Det er klart, at hvis man giver celler en masse skader, vil de forsøge at reparere på sig selv, men det er ikke under naturlige forhold. I dag er fokus mere rettet mod at forstå, hvad cellerne gør, når de ikke bliver udsat for så ekstreme ting, men at de bare skal klare sig gennem dagen og livet i en menneskekrop,« siger Lotte Bjergbæk.
Har betydning for behandling af kræft
Opdagelserne de seneste år og i fremtiden handler ikke bare om at forstå, hvordan cellecyklus bliver reguleret, eller hvordan kræft opstår, men også hvad man kan gøre, når tingene går galt.
Som eksempel står det nu klart, at hvis en kvinde mangler funktionelle BRCA-proteiner, har hun øget risiko for brystkræft. Derfor forsøger forskere at lave lægemidler, der beskadiger celler på en måde, så kun BRCA -proteiner kan reparere dem. Det vil sige, at raske celler med funktionelle BRCA-proteiner bliver repareret, mens kræftceller uden BRCA bliver beskadiget i et omfang, der får cellerne til at gå i apoptose.
»Vi er dog også blevet mere opmærksomme på, at kroppen og cellerne har mange sikkerhedssystemer indbygget, så det er ikke altid, at cellerne opfører sig, som vi tror. Nogle gange kan de få tingene til at virke på en anden måde, hvis en primær signalvej bliver sat ud af kraft. Det er vi også nødt til at have i betragtning, når vi vil udvikle lægemidler til behandling af sygdomme, som udspringer fra fejl i cellecyklus og cellekontrol,« siger Lotte Bjergbæk. ♦
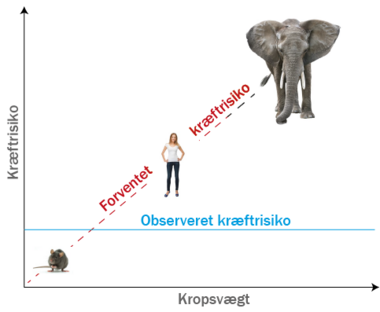
Petos paradoks
Store dyr som elefanter og blåhvaler har en meget lavere risiko for at udvikle kræft sammenlignet med mindre dyr som for eksempel os mennesker. Dette er en interessant biologisk observation, da kræft normalt er forbundet med celledeling og vækst, som store dyr med flere celler og en længere levetid har flere og mere af. Problemstillingen kaldes for Petos paradoks. Der findes flere mulige forklaringer på Petos paradoks, om hvorfor store dyr har mindre risiko for udvikling af kræft sammenlignet med mindre dyr:
DNA-reparation: En mulig forklaring er, at store dyr har mere effektive mekanismer til at reparere DNA-skader, som kan føre til kræft. DNA-reparationssystemer kan muligvis arbejde langsommere i mindre dyr, som har kortere levetid og dermed mindre pres på deres DNA-reparationssystemer.
Antioxidanter: Store dyr har også højere niveauer af antioxidanter i kroppen, hvilket kan hjælpe med at beskytte cellerne mod skader og kræft. Antioxidanter kan også hjælpe med at reducere betændelse, som kan føre til celleskader og kræft.
Stofskifte: En anden mulig forklaring er, at store dyr har et lavere stofskifte, hvilket betyder, at de har en langsommere celledeling og dermed lavere risiko for at opleve mutationer, som kan føre til kræft.
Genetisk disposition: Endelig kan genetisk disposition også spille en rolle i, hvorfor store dyr har en lavere risiko for kræft. Mange af de gener, der er involveret i at undertrykke tumorer og beskytte mod kræft, er mere almindelige i store dyr. Disse gener kan være blevet bevaret gennem evolutionen, fordi de giver en fordel for store dyr, der er mere modtagelige for kræft. Elefanter indeholder blandt andet mange p53-gener, som undertrykker udvikling af tumorer. Det gør hvaler dog ikke.