Nyt lys på epigenetikkens molekylærbiologi
I disse år er mange forskere optaget af epigenetikken; altså at faktorer udefra i kortere eller længere tid kan ændre på, hvordan en celles ellers uforanderlige gener kan variere i udtryk. En af disse forskere er Jasmin Mecinovic, der er professor på Institut for Kemi, Fysik og Farmaci ved SDU. Han har for nylig modtaget godt 13 millioner kroner fra Novo Nordisk Fonden til at forske i, hvad der foregår på det molekylære niveau, når der indtræffer en bestemt epigentisk påvirkning af et gen.
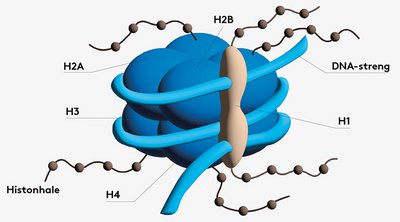
Epigenetiske påvirkninger – om de er tilsigtede fra naturen eller udløst af miljøpåvirkninger – igangsætter kemiske ændringer af nogle strukturer, der har tæt tilknytning til selve DNA’et inde i hver eneste cellekerne. Disse strukturer kaldes histoner, og de udgør først og fremmest et skelet, som de to meter lange DNA-strenge kan vikles op om. Men de har også billedligt talt en hale, der stikker uden for DNA’et. Den kan enzymer hæfte, fjerne eller genkende små kemiske “tags” på, og når det sker, sendes der besked gennem histonet om, at der skal tændes eller slukkes for nogle af DNA’et mange gener.
Hvor og hvordan, enzymer sætter disse tags på histonerne, og hvordan sådanne ændringer kontrollerer de genetiske udtryk er et kæmpe puslespil, som forskerne kun i de seneste cirka 30 år har haft mulighed for at udforske. Ændringerne er nemlig så små, at det har krævet ekstremt avancerede kemiske værktøjer at kigge ind i histonernes verden.
Af samme årsag har man indtil nu beskæftiget sig mest med de fire kernehistoner, som DNA-strengene vikler sig om. Men der findes et femte histon, kaldet linker H1, som er så uregerligt, at det indtil for ganske nyligt har været umuligt at studere med eksisterende teknikker. Jasmin Mecinovic beskriver det, som om dette histon har “spaghettiarme, der hele tiden flagrer rundt”. En af opgaverne for Jasmin Mecinovic’s forskningsgruppe bliver derfor at udvikle nogle kemiske metoder, som overhovedet gør det muligt at se, hvad der foregår i de epigenetiske kringelkroge af det uregerlige H1-histon. Ligesom de øvrige histoner har H1 også en hale, der sidder udenfor DNA’et. Også den kan blive modificeret af enzymer, så der via H1 kan opstå ændringer på generne inde i cellekernen.
»En anden vigtig opgave bliver at forsøge at bygge H1-histoner, som vi kan modificere specifikt til at ligne naturlige H1-histoner for så at se, hvilken effekt, det kan få på interaktionen med histoner, epigenetiske proteiner og DNA,« siger Jasmin Mecinovic.
At studere, hvordan H1-histoner interagerer med andre biomolekyler på molekylært niveau, er kemisk grundforskning. Men det er også sygdoms- og medicinal-relateret forskning, fordi histonerne kan forårsage uhensigtsmæssige aktiveringer eller slukninger af gener og dermed føre til sygdomme som visse kræftsygdomme og autoimmune sygdomme.
Birgitte Svennevig, journalist,
Det Naturvidenskabelige Fakultet og SDU Climate Cluster