
CRISPR: Et genetisk værktøj mod sygdomme
Den genetiske “saks” CRISPR har revolutioneret arbejdet med og forskningen i gener. Forskere arbejder nu intenst på at knække koden til at kunne bruge dette værktøj til at kurere en lang række sygdomme.
Af Kristian Sjøgren, videnskabsjournalist.
Vi har i snart 20 år levet i en genetisk æra, hvor forståelsen af genetikken bag det at være et menneske er eksploderet. Samtidig har vi lært, hvad der går galt på det genetiske niveau, når folk er arveligt syge.
Selvom vi efterhånden har haft denne viden i et stykke tid, har vi endnu ikke haft muligheden for at benytte den til at kurere sygdommene. Der er dog lys i horisonten for de mange millioner af mennesker, som lider af alt fra blodsygdomme, muskelsvind, immunsygdomme, cystisk fibrose, Huntingtons sygdom og mange flere, som alle har et udspring i en mutation, altså en genetisk fejl i cellernes arvemateriale.
Dette lys kommer fra noget så simpelt som bakterier, der fra naturens hånd er udstyret med et molekylært kompleks, der går under den mundrette betegnelse CRISPR-CAS9, som i praksis fungerer som en genetisk saks. Saksen har forskere arbejdet med og udviklet i mere end et årti, og nu står de på tærsklen til at tage værktøjet i brug og gøre en lang række sygdomme til et fjernt fortidsminde.
En af de forskere, som er med til at drive udviklingen i den revolutionerende genteknologi fremad, er professor Jacob Giehm Mikkelsen fra Institut for Biomedicin ved Aarhus Universitet. Jacob Giehm Mikkelsen forsker i udvikling af CRISPR-teknologien.
»Selvom andre former for genterapier er begyndt at have succes i forhold til behandling af forskellige sygdomme, er de nuværende terapier ikke perfekte. Næste skridt er derfor at blive i stand til at gå direkte ind i de syge celler hos folk med en given sygdom og korrigere den mutation, som er ophav til sygdommen. Det har tidligere været umuligt, men CRISPR-teknologien åbner op for, at det kan lade sig gøre. Der er blevet forsket i denne mulighed i mange år, og vi er nu ved at være der, hvor de første behandlinger er færdigudviklede,« fortæller Jacob Giehm Mikkelsen.
Lang række sygdomme kan kureres med genteknologi
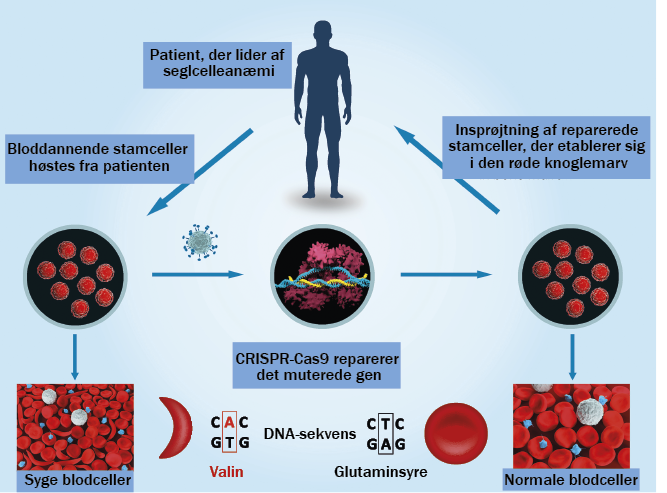
Når vi taler om muligheden for at reparere på mutationer i defekte gener og gøre folk raske, er det vigtigt at skelne mellem forskellige typer af genetiske sygdomme. Nogle genetiske sygdomme er resultatet af flere hundrede mutationer, og her er det indtil videre svært at forestille sig, at man skal rette op på dem alle sammen med CRISPR-teknologi. Andre sygdomme er til gengæld resultatet af én enkelt genetisk mutation, som handikapper et gen og leder til sygdom. Det gælder blandt andet lunge sygdommen cystisk fibrose eller blodsygdommene seglcelle-anæmi og betathalassæmi.
Ved de sygdomme, som er kendetegnet ved blot én ødelæggende mutation, er det tanken med CRISPR, at læger med den genetiske saks kan gå ind og erstatte den defekte del af genet med en del, der fungerer, som den skal.
»Det er selvfølgelig ikke uden udfordringer at identificere, hvilken af arvemassens seks milliarder byggesten der er årsag til sygdom, og som skal udskiftes. Det er i nogle tilfælde som at finde en nål i en høstak. Samtidig kan vi ikke have, at den genetiske saks klipper alle mulige andre steder end der, hvor der er en mutation. Den skal klippe meget præcist, og det er muligheden for at lave disse meget præcise klip i arvemassen, som vi og tusindvis af andre forskere verden over har arbejdet på de seneste mange år,« forklarer Jacob Giehm Mikkelsen.
Behov for flere komponenter for at reparere på DNA
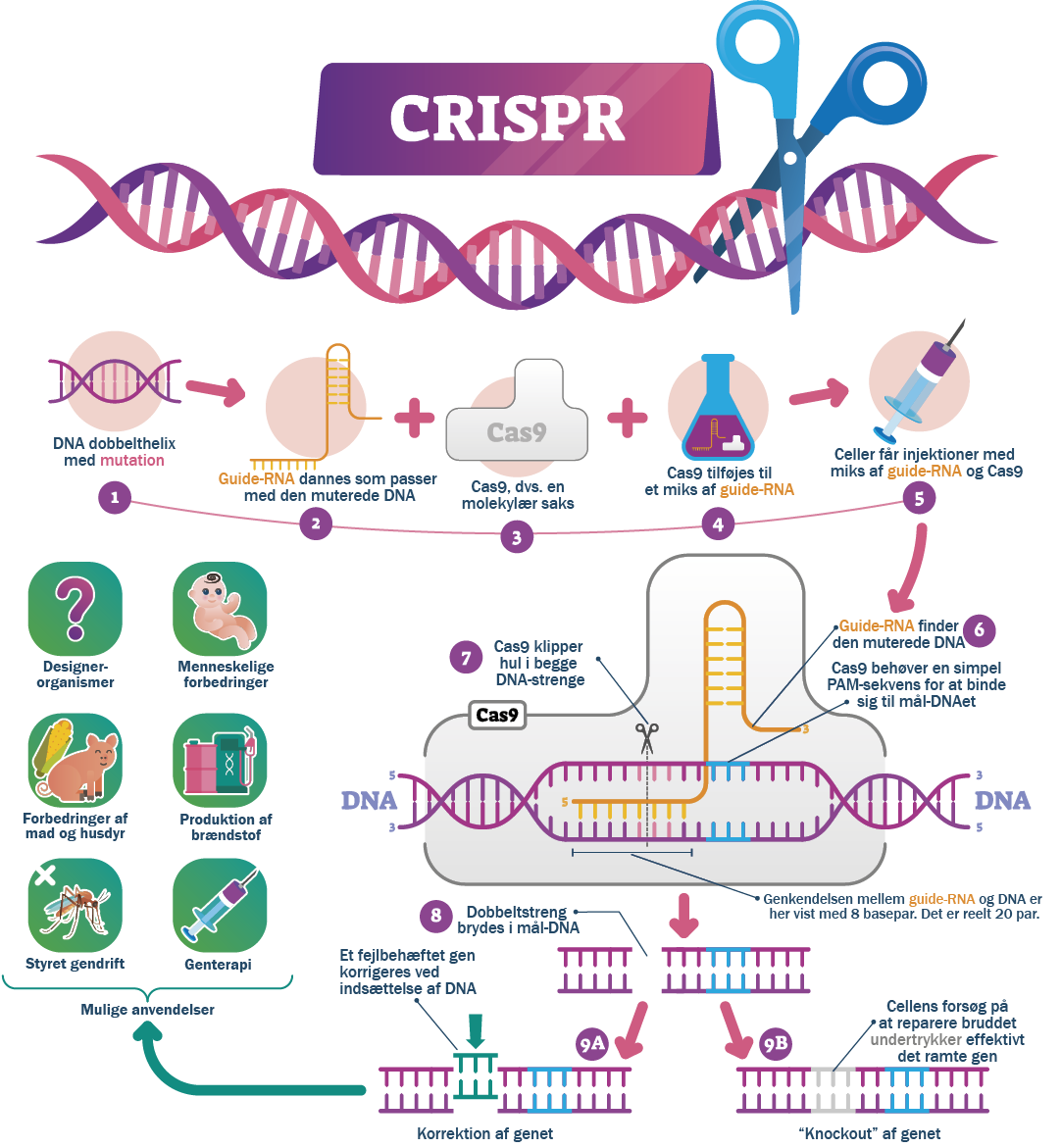
For at CRISPR-teknologien skal kunne reparere et defekt gen, har den brug for tre specifikke komponenter:
- For det første skal den genetiske saks være til stede, og den hedder CAS9 og kommer fra bakterier. Bakterierne har fra naturens hånd udviklet CAS9 til at klippe i fremmed arvemateriale. Den er en del af bakteriernes forsvar mod blandt andet virus.
- Derudover er der også behov for et lille stykke arvemateriale i form af guide-RNA (gRNA) til at styre, hvor CAS9 klipper. Guide-RNA’et matcher meget simpelt op med et stykke af arvematerialet og trækker dermed CAS9 derhen, hvor proteinet skal klippe. Det vil sige, at hvis forskere vil klippe en skadelig mutation ud af syge celler, skal de udstyre CAS9 med en guide-RNA-sekvens, som matcher lige netop det sted på arvemassen, hvor sygdommen udspringer fra.
- Til sidst, men ikke mindst, skal man også bruge en donorsekvens, der kan bruges som en skabelon, når den overklippede DNA-streng skal repareres. Herved repareres ikke bare hullet, men også eventuelle mutationer, der ligger tæt ved hullet. Forsyner man ikke cellerne med en donorsekvens, prøver de bare at lime den overklippede DNA-streng sammen igen, og det reparerer ikke genet. Der er brug for den genetiske pendant til en cykellap.
»Med konventionelle genterapier introducerer man et gen som erstatning for et muteret gen, men det er ikke til at sige, om den form for genterapi stadig virker om fem år. Med CRISPR retter vi i stedet op på cellernes egne gener, og så er der ingen grund til at tro, at udbedringen af skaden bryder op igen,« siger Jacob Giehm Mikkelsen.

DNA repareres i laboratoriet
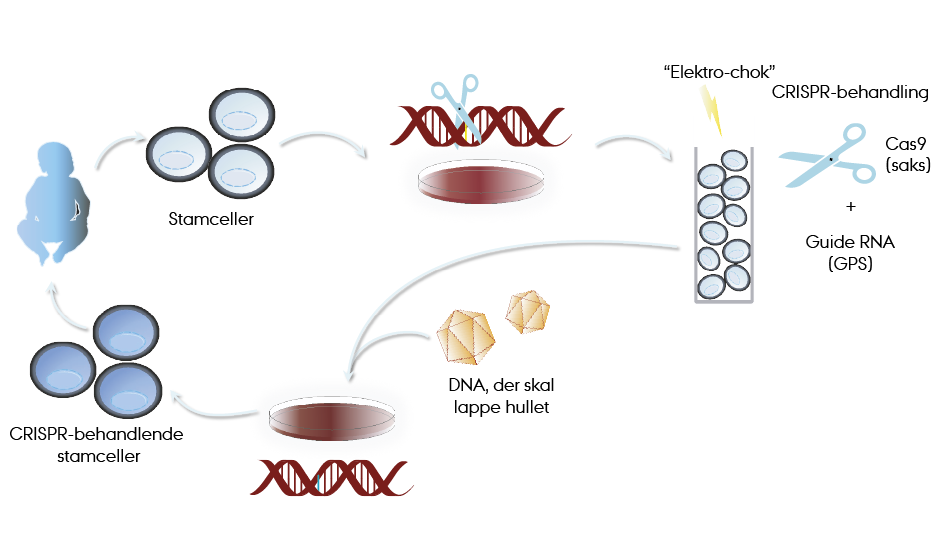
Jacob Giehm Mikkelsen fortæller, at det for nogle sygdomme vil være mest relevant at reparere på stamcellerne, fordi de bliver ved med at dele sig og danner dermed udgangspunktet for milliarder af nye celler. Kan man rette op på generne i stamceller, behøver man ikke gøre det i alle dattercellerne.
Et oplagt eksempel på brugen af CRISPR til behandling af sygdom er indenfor behandling af blodsygdomme som seglcelleanæmi eller immunsygdomme, der giver nedsat forsvar mod virus- og bakterieinfektioner. Her skal man forestille sig, at læger høster stamceller fra patienternes blod, reparerer defekten i stamcellernes arvemateriale med den ovennævnte metode og derefter sprøjter dem ind i patienten igen.
Da skaden er udbedret i stamcellerne, vil de reparerede stamceller efterfølgende dele sig og producere store mængder af raske celler. Alt sammen lyder måske meget simpelt, men der eksisterer nogle komplicerende trin i processen, som gør det lidt sværere, end det umiddelbart kan virke.
Først og fremmest skal CAS9, guide-RNA’et og donor-DNA’et ind i cellerne, og det er ikke sådan lige til. Forskere har dog udviklet en metode, hvor de giver cellerne “elektrochok”, hvilket får dem til at åbne sig, så de genetiske værktøjer kan komme ind i først væsken (cytoplasmaet) inde i cellerne og derefter helt ind i cellekernen, hvor de skal udføre deres arbejde.
Faktisk benytter forskerne elektrochok til at få CAS9 og guide-RNA’et ind i cellerne, mens donor-DNA’et bliver leveret af en såkaldt adeno-associeret virus, som med en kirurgs præcision leverer DNA-stumpen lige der, hvor den skal bruges.
»Den teknik er vi blevet supergode til at udføre. Har vi 100.000 celler med 200.000 gener, som vi gerne vil reparere, kan vi med denne fremgangsmåde få næsten dem alle sammen repareret. Problemet er dog, at vi er nødt til at få cellerne ud af kroppen for at kunne gøre det. Vi kan ikke give for eksempel leveren elektrochok for at behandle en genetisk leversygdom med CRISPR,« forklarer Jacob Giehm Mikkelsen.
Jacob Giehm Mikkelsen og hans forskergruppe arbejder selv meget med at udvikle en behandling til personer med immunsygdommen GATA2-defekt, hvor den genetiske defekt gør, at kroppens immunceller ikke udvikles ordentligt. Personer med GATA2-defekt er i konstant risiko for at blive smittet med virus og bakterier og blive alvorligt syge af det, da de ikke har et godt værn mod dem.
»Indenfor hver sygdom gælder det om at lave nogle protokoller til at lave de genetiske ændringer, der kan eliminere sygdommen. Først skal tingene undersøges på celler, derefter i dyremodeller og til sidst i mennesker. I dag er nogle protokoller allerede fremme ved forsøg på mennesker, så vi er lige ved at være der, hvor de første behandlinger på baggrund af CRISPR-teknologien kan afprøves i kliniske forsøg,« siger Jacob Giehm Mikkelsen.
Vil lave HIV til transportør af genetisk saks
Jacob Giehm Mikkelsen og hans kollegaer arbejder på at ombygge Human Immundefekt Virus (HIV), således af virus kan transportere CAS9 og guide-RNA ind i celler med fejl i den ge-netiske kode. HIV er interessant, fordi denne virus i forvejen er bygget til at trænge ind i celler og levere et indhold i cellerne og cellekernen.
Virus binder til en receptor på overfladen af celler, og forskerne fra Aarhus Universitet har allerede vist, at de kan pakke CAS9 og guide-RNA som et færdigt kompleks ind i virus sammen med donorsekvensen. Derved bliver alle værktøjerne leveret som en færdig pakke til at reparere på muteret DNA.
Mange bliver måske skræmt af tanken om at blive inficeret med HIV, men forskerne har fjernet alle de sygdomsfremkaldende træk ved virus, så de hverken kan sprede sig eller gøre skade på kroppen.
Jacob Giehm Mikkelsen fortæller, at fordelen ved at bruge nanopartikler baseret på HIV er, at virus hurtigt trænger ind i cellerne og leverer deres last lige der, hvor der er brug for det. Det vil sige, at medicin baseret på denne teknologi vil virke inden for ganske få timer. Samtidig efterlader den slags nanopartikler ikke gener i cellerne, og efter to til tre dage er det hele væk igen, og tilbage er kun udbedringen af mutationen.
Forskerne har allerede nu indikationer på, at de med teknologien kan udbedre arvelige øjensygdomme, der er resultatet af genetiske mutationer.
Vil bringe genetisk saks ind i kroppen
Problemet med mange af de protokoller, som er langt fremme i forskningen i dag, er, at de kræver, at celler trækkes ud af kroppen og behandles i en dyrkningsflaske i laboratoriet. Det gør for det første behandlingen meget dyr, og det begrænser også antallet af sygdomme, som potentielt set kan udbedres med CRISPR.
Forskerne inden for området arbejder derfor intenst på at udvikle protokoller, hvor hele reparationsarbejdet kan flyttes ind i kroppen og ind i cellerne, der hvor de findes. Det kan være i musklerne, i hjernen eller i andre organer.
Jacob Giehm Mikkelsen fortæller, at der i øjeblikket er ekstremt stort fokus på dette næste udviklingstrin, og at der kastes enorme summer efter at få det til at kunne lade sig gøre.
Det første problem er, at uanset hvordan man vender og drejer det, skal man som udgangspunkt stadig have CAS9, guide-RNA og donorsekvens ind i cellerne, men uden at benytte sig af elektrochok.
Her ser det dog umiddelbart ud til, at naturen igen kommer med en håndsrækning. En mulig løsning er nemlig at anvende et virus, for eksempel adeno-associeret virus, til at levere den genetiske kode for CAS9 og guide-RNA ind i cellerne. Det kan den også gøre med donorsekvensen. Derved vil det få cellerne til selv at producere de værktøjer, som skal til for at reparere en genetisk defekt.
Løsningen er dog ikke uden problemer. »Det vil efterlade den genetiske kode til at producere CAS9 og guide-RNA inden i cellerne, og der vil de også være, efter de har udført deres arbejde. Man kan være nervøs for, at hvis vi efterlader de genetiske sakse inde i cellerne i flere måneder, at de vil begynde at klippe i alt muligt andet, som de ikke skal klippe i. Derfor er brugen af adeno-associeret virus og den genetiske kode for CAS9 og guide-RNA ikke drømmescenariet.
Vi har behov for en løsning, hvor komponenterne til at reparere den genetiske defekt bliver leveret som et lægemiddel, der har en effekt for derefter at forsvinde ud af kroppen igen,« fortæller Jacob Giehm Mikkelsen.
Transkription, revers transkription og translation
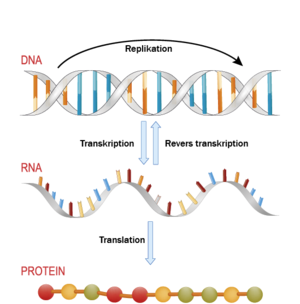
Inden en celle deler sig, foregår der DNA-replikation, hvor der laves en nøjagtig kopi af alle kromosomers DNA-molekyler, så dattercellerne har nøjagtige kopier af det oprindelige DNA.
I forbindelse med proteinsyntese sker der først en transkription, hvor der opbygges et mRNA-molekyle ud fra baserækkefølgen i den ene DNA-streng inde i cellekernen. mRNA diffunderer derefter ud i cytoplasmaet, hvor der sker en translation, hvor opbygningen af protein sker ud fra informationerne i mRNA. Baserækkefølgen i DNA og dermed mRNA afgør rækkefølgen af aminosyrer i proteinet.
Visse RNA-vira indeholder et enzym, revers transkriptase, der kan katalysere en revers transkription, altså dannelse af DNA ud fra mRNA.
Fedtpartikler kan bringe saks ind i celler
En løsning på problemet med virus kan måske komme fra udviklingen af vacciner mod COVID-19.
I forbindelse med pandemien kom en særlig teknologi til at levere vacciner mod coronavirus nemlig i spil. Der er tale om såkaldte lipid-nanopartikler eller LNP’er.
LNP’er er i essensen fedtklumper, som forskere kan putte forskellige ting i for at få dem ind i celler. I forbindelse med udvikling af coronavacciner puttede forskere messenger-RNA (mRNA), der koder for spike-proteinet, ind i LNP’erne, så spike-proteinet kunne produceres i kroppen og finde vej til immunforsvarets celler.
På samme måde er forskere nu ved at udvikle metoder til at få LNP’er til at levere CAS9 og guide-RNA ind i celler uden brug af elektrochok. Udfordringen er at få LNP’erne til at være målrettede, så CAS9 og guide-RNA bliver leveret til de rigtige celler i kroppen, for eksempel i leveren, og ikke ender i celler, hvor behandlingen ikke er relevant.
»Det forsøger man at gøre med overfladeproteiner på LNP’erne. De sørger for, at LNP’erne kommer det rette sted hen. Den teknologi ser superinteressant ud i forhold til at kunne behandle med CRISPR indeni kroppen på mennesker med en genetisk sygdom,« forklarer Jacob Giehm Mikkelsen.
Ny teknologi er kompliceret, men lovende
Også inden for andre områder bliver der forsket i at lave forbedringer af mulighederne for at bruge CRISPR til at udbedre genetiske fejl i arvemassen.
En gruppe amerikanske forskere har blandt andet udviklet en metode, så de ikke har brug for donor-DNA til at udbedre skaden. Derved skal forskerne kun bruge CAS9 og guide-RNA.
Teknologien hedder “prime editing” og består af CAS9, guide-RNA og så proteinet revers transkriptase, som kan oversætte RNA til DNA. Revers transkriptase har forskerne fusioneret til CAS9, og når CAS9 binder til det rette gen, er revers transkriptase i stand til ud fra en medfølgende stump RNA at lave den DNA-bid, der skal erstatte det sted, som CAS9 klipper ud af genet.
Det lyder kompliceret, og det er det også, men når det virker, virker det super effektivt. Det har forskerne fra Aarhus Universitet også set, og de forsøger at udvikle teknologien til at bruge den på patienter med GATA2-defekt, der er en dominant nedarvet defekt i immunsystemet.
»Prime editing virker meget lovende i forhold til at kunne udvikle CRISPR-teknologien til at være et decideret lægemiddel. Derudover kræver prime editing ikke, at man skærer begge DNA-strenge over, men kun den ene. Det minimerer også risikoen for dobbelte brud på DNA’et, hvilket kommer med forøget risiko for mange andre ting. Når vi taler om at bruge prime editing til at kurere genetiske sygdomme, er vi helt ude ved fronten af den teknologiske udvikling, men det er den vej, som tingene går inden for udvikling af nye behandlinger til sygdomme, som vi ikke kan gøre noget ved i dag,« fortæller Jacob Giehm Mikkelsen. ♦
Sygdomme på grund af mutationer i kun ét gen
Disse sygdomme skyldes mutationer i enkelte gener, der koder for givne proteiner. Sygdommene kan potentielt set kureres, hvis man kan reparere den underliggende mutation.
- Huntingtons sygdom er en sygdom i nervesystemet, der skyldes en enkelt mutation i Huntington-genet
- Lungesygdommen cystisk fibrose (mutation i CFTR-genet)
- Hæmokromatose, der giver anledning til ophobning af jern i kroppen (mutation i HFE-genet)
- Duchennes muskeldystrofi, der er en muskelsvindssygdom (mutation i dystrofin-genet)
- Blodsygdommen seglcelleanæmi (mutation i beta-globin-genet)
- Familiær hyperkolesterolæmi, der leder til markant forhøjet kolesterol i blodet (mutation i LDL-receptor-genet)
- Den neurodegenerative sygdom Tay-Sachs (mutation i hexosa-minidase A-genet)
- Medfødt døvhed (mutation i GJB2-genet, der koder for protei-net connexin 26)
Derudover findes der flere tusinde mere eller mindre sjældne sygdomme og syndromer, der kan relateres til mutationer i enkelte gener.
Arbejdsark om CRISPR
Arbejdsarket knytter an til artiklen CRISPR: Et genetisk værktøj mod sygdomme fra nr. 5-2022 med genforsker Jacob Giehm Mikkelsen. Arbejdsarket består af fem opgaver, der spænder fra forståelse af grundlæggende begreber og koncepter i forbindelse med genteknologi og specifikt CRISPR-cas9 til diskussion af potentielle anvendelser af CRISPR-teknologien.
Hent arbejdsarket CRISPR: Et genetisk værktøj mod sygdomme (word).
