Epigenetik - Hvordan små metylgrupper kan påvirke vores aldring
Små kemiske modifikationer af vores DNA – såkaldte metyleringer – spiller en vigtig rolle for, hvordan generne kommer til udtryk gennem livet. Meget tyder på, at de dermed også er vigtige for, hvordan vi ældes. Det er interessant, da en metylering ikke nødvendigvis er en permanent ændring..
Af Stine Asmussen, Mette Sørensen Thinggaard og Tinna Stevnsner
At vi ældes er en uundgåelig kendsgerning, men hvordan vi ældes varierer i høj grad fra person til person. Det store spørgsmål er, hvad der ligger bag denne store variation, som kommer til udtryk som store forskelle i livslængde samt fysisk og psykisk velvære, når man kommer op i årene.
En del af forklaringen skal findes i variationer – og i nogle tilfælde mutationer – i vores DNA, som kan være enten medfødte eller erhvervet i løbet af livet. Variationerne kan komme til udtryk som en disposition for at udvikle aldersrelaterede sygdomme som kræft eller som en disposition for førtidige aldringssymptomer. Men det handler ikke kun om, hvilke gener vi er udstyret med – det handler også om, hvordan genernes aktivitet ændrer sig med alderen. Forandringer i genaktiviteten kan for eksempel skyldes såkaldte epigenetiske forandringer. Epigenetiske forandringer ændrer ikke selve DNA-opskriften, men de kan modulere, hvor effektivt gener udtrykkes. Derfor kan indsigt i epigenetik og epigenetiske forandringer bidrage til vores forståelse af den store variation i, hvordan vi ældes samt udviklingen af aldersrelaterede sygdomme.
Epigenetikkens overordnede rolle
“Epi” stammer fra græsk og betyder “på”. Epigenetik handler altså om forandringer oven på selve DNA-sekvensen. Det involverer forskellige kemiske modifikationer af DNA’et, som kan slukke eller tænde, altså inaktivere eller aktivere, vores gener. Modulering af geners aktivitet bidrager til, at vores krops celler kan påtage sig vidt forskellige opgaver – lige fra at være en levercelle til en hudcelle eller en hjernecelle. Alle celler har den samme opskrift, men epigenetikken bidrager væsentligt til, at kroppens celler i al deres diversitet læser og fortolker DNA’et forskelligt.
Metylering
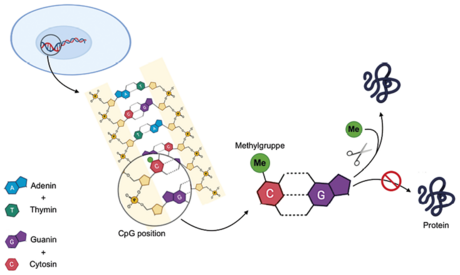
Hver cellekerne i kroppen indeholder identiske kopier af DNA. DNA har form som en snoet dobbeltstreng, hvor hver streng er opbygget af såkaldte nukleotider med fire forskellige baser: adenin (A), thymin (T), guanin (G) og cytosin (C). Menneskets genom består af cirka 6 milliarder baser, og baserne på de to strenge sidder overfor hinanden i bestemte par, således at adenin altid er parret med thymin på den modstående streng, og guanin altid er parret med cytosin.
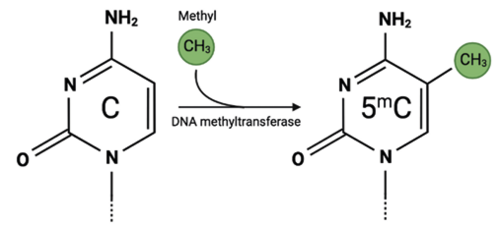
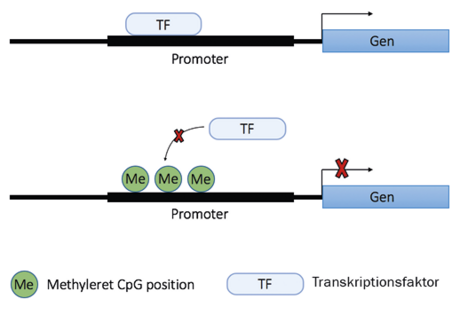
Basen cytosin kan metyleres ved, at der sættes en metylgruppe (CH3) på den. Cirka 1% af alle DNA-baser i genomet er metylerede cytosiner. Metyleringer ses i forbindelse med en CpG-position, altså når cytosin efterfølges af guanin på DNA-strengen. Regulerende områder af DNA’et (såkaldte promotere), som er med til at styre, hvor meget et gen udtrykkes, indeholder ofte mange CpG-positioner. Metylering af en CpG-position i et sådant regulerende område medfører, at såkaldte transskriptionsfaktorer ikke kan binde til sekvensen, hvilket betyder at aflæsningen af genet blokeres, så det ikke kan komme til udtryk. Hvis metylgruppen fjernes, tillader det modsat aflæsning, så det protein, som genet koder for, kan udtrykkes.
En meget almindelig epigenetisk modifikation er, at der kobles en metylgruppe (den kemiske gruppe CH3) til basen cytosin. Dette kaldes en metylering. Disse ses hovedsagligt, når cytosin (C) efterfølges af basen guanin (G) i DNA’et, og det kalder man for en CpG-position. Enzymer kaldet DNA-metyltransferaser sørger for at sætte metylgrupper på cytosiner. Flere og flere undersøgelser peger på, at et gen inaktiveres, hvis der er metyleringer i det gen-regulerende område kaldet genets promoter, som bestemmer, hvor aktivt et gen er.
DNA-metylering spiller altså en væsentlig rolle i regulering af gener livet igennem – lige fra man er et foster i sin mors mave, til man er fuldt udviklet som et voksent menneske. Hvis DNA-metyleringerne af en eller anden grund bliver unormale, risikerer de at bidrage til udviklingen af sygdomme og/eller nedsættelse af den kognitive og fysiske kunnen.
Hvis man ser på den totale mængde af cytosin-metyleringer, falder den med alderen. Men når man kigger mere lokalt i DNA’et, for eksempel i promotorer, ser man et forøget antal cytosin-metyleringer med alderen. Metylering i promotorer leder til forstyrrelse af det normale udtryk af de givne gener og dermed mængden af det protein, som de koder for. Metyleringer kan nemlig blokere adgangen for transskriptionsfaktorer – proteiner der binder til promotorer og dermed bidrager til at regulere udtrykket af et specifikt gen. Hvis udtrykket af genet er vigtigt for, hvorvidt man risikerer at udvikle en alvorlig sygdom, kan ændringer i gen-promotorens metylering altså få alvorlige konsekvenser.
Som vi skal se senere, kan både alder og miljø bidrage til forandringer i det epigenetiske mønster. Men det er vigtigt at bemærke, at metyleringer og andre epigenetiske ændringer er reversible – det er altså ikke nødvendigvis permanente ændringer.
Epigenetik og den aldrende hjerne
Hjernen har en relativt stor iltomsætning, og en konsekvens heraf er, at der produceres en stor mængde reaktive iltforbindelser, som blandt andet fører til oxidativ beskadigelse af hjernecellernes DNA. Effektive DNA-reparationsprocesser i cellen sørger normalt for at fjerne langt de fleste af disse skader, men der sker dog alligevel en vis ophobning med alderen. For at få bedre indsigt i, hvorledes reparationen af oxidative DNA-skader i hjernen reguleres, er der blandt andet brug for detaljerede undersøgelser af forekomsten af epigenetiske forandringer i promoteren for de forskellige gener, der koder for reparationsproteinerne.
Man har for nyligt kunne vise, at promotorer for en række gener, der er involveret i reparation af oxidative DNA-skader, er mere metylerede hos ældre individer. Det ændrede metyleringsmønster stemmer overens med, at man har set nedsat udtryk af visse DNA-reparationsgener. I forbindelse med et forskningsprojekt på Aarhus Universitet har Stine Asmussen og Tinna Stevnsner sammen med nogle af deres kollegaer blandt andet undersøgt metyleringen af CpG-positioner i promoteren for et stort antal gener, som koder for proteiner involveret i reparationen af oxidative DNA-skader. De foreløbige resultater har vist, at de vigtige CpG-positioner i promotoren for disse gener er metylerede i ældre mus, og at det medfører en nedsat binding af transskriptionsfaktoren CREB.
Denne transkriptionsfaktor er central for regulering af udtrykket af en hel række gener inklusiv gener, som koder for proteinerne, der reparerer de oxidative DNA-skader. Det er derfor sandsynligt, at når de vigtige CpG-positioner er metylerede i ældre mus, så binder CREB i mindre grad, og derfor bliver DNA-reparationsgenerne mindre aktive. Der vil derfor blive lavet færre DNA-reparationsproteiner, og kroppens evne til at reparere skader i DNA’et vil blive nedsat. Konsekvensen er, at DNA-skaderne ophobes med alderen og indvirker negativt på hjernens funktion.

Disse mekanismer kan også tænkes at være relevante for en række neurodegenerative sygdomme hos mennesket. Eksempelvis har epigenetiske forandringer været fremført som centrale for Alzheimers sygdom, hvor flere studier har fundet epigenetiske forskelle i hjernevæv fra individer med Alzheimers sygdom sammenlignet med raske kontrol-individer. Andre studier har fundet et forøget niveau af oxidative DNA-skader i hjerner fra individer med Alzheimers sygdom sammenlignet med raske personer på samme alder. Dog er studier, som undersøger både niveauet af DNA-skader og metylering i de samme mennesker relativt sjældne, hvilket gør det vanskeligt at etablere en direkte forbindelse. Der mangler derfor mere forskning på området.
Tvillingestudier belyser betydning af epigenetiske forandringer
Der er forholdsvis store individuelle forskelle på, hvordan metyleringsmønsteret ændrer sig med alderen. Det skyldes blandt andet påvirkning fra nogle af de mange miljøfaktorer, man udsættes for dagligt. Det kan man blandt andet se, når man undersøger enæggede tvillinger, som med alderen bliver indbyrdes mere og mere forskellige i deres epigenetiske mønster. Ved at undersøge forskelle imellem enæggede tvillingers epigenetiske forandringer kan man udelukke den indflydelse, som den genetiske baggrund måtte have på epigenetikken. De epigenetiske forskelle, man ser hos de enæggede tvillinger, kan derfor antages at skyldes forskelle i livsstil og andre påvirkninger fra det omgivende miljø, som de to tvillinger hver især har gennemlevet.
Mette Sørensen Thinggaard og hendes kollegaer ved SDU har ved hjælp af tvillingestudier blandt andet fundet korrelationer imellem fysisk styrke i alderdommen og epigenetisk variation i gener, der er involveret i immunologiske processer og gigt. De har også fundet korrelationer imellem hjernens kognitive funktion i alderdommen og epigenetisk variation i gener involveret i eksempelvis signalering i hjernen samt Alzheimers sygdom. Der arbejdes i skrivende stund videre med disse analyser, for eksempel med henblik på at bekræfte fundene i andre tvillinger.
Tvillingestudier og aldringsprocessen
Enæggede tvillinger er resultatet af et enkelt æg befrugtet af en sædcelle, hvorimod tveæggede tvillinger er resultatet af to forskellige æg befrugtet med hver sin sædcelle. Derfor er enæggede tvillinger genetisk set identiske, imens de tveæggede i gennemsnit deler halvdelen af den genetiske kode ligesom ethvert andet søskendepar. På grund af denne forskel i genetisk lighed har tvillinger bidraget betydeligt til genetisk epidemiologisk forskning i årtier.
Man har ved sammenligning af lighed i fænotyper (dvs. ydre fremtoning, fysiologi, egenskaber og sygdomme) indenfor tvillingparrene kunnet beregne, hvor meget af variationen i en fænotype, der skyldes genetik, og hvor meget der skyldes miljø. Hvis to enæggede tvillinger eksempelvis forbliver mere ens med hensyn til en given fænotype i løbet af livet end to tveæggede tvillinger gør, så skyldes variationen i fænotypen først og fremmest gener og i mindre grad forskelle i miljø og livsstil.
Ved at undersøge forskelle i fænotyper indenfor enæggede tvillingepar kan man finde biologiske markører, herunder epigenetiske forskelle, der bidrager til variationen af fænotypen. Den teknologiske udvikling har i de seneste par årtier endda gjort det muligt at undersøge mange biologiske markører på én gang via såkaldt array-teknik, som efterfølgende kan benyttes til statistisk analyse på tværs af hele genomet. Sådanne arrays benyttes nu om dage til at undersøge både genetisk variation (i DNA’et), epigenetisk variation (CpG-positioner), gen-ekspression (udtrykket af de enkelte gener) og protein-forekomst (gen-produktet).
Forskningsresultater for tvillinger anses også for at være gældende for enkeltfødte individer. For selvom tvillinger har et lidt anderledes miljø i moders mave sammenlignet med enkeltfødte, har klassiske epidemiologiske studier vist, at tvillingers helbred og liv minder meget om enkeltfødte individer, fraregnet en lidt højere dødelighed i de første par uger lige efter fødslen samt lidt lavere selvmordsrater og skilsmisserater i voksenlivet.
Epigenetik og effekten af cancerbehandling
Mange kemoterapeutika virker ved, at de introducerer skader i kræftcellernes DNA. For at opnå en god effekt af behandlingen er det derfor vigtigt, at kræftcellerne ikke har en særlig stor kapacitet for at reparere DNA. Et af de reparationsproteiner, som kræftceller bruger til at reparere DNA-skader, som visse kemoterapeutika påfører kræftcellerne, kaldes MGMT (der står for O6-metylguanine-DNA metyltransferase). Faktisk bruger man ligefrem metyleringsniveauet i promotoren for genet, der koder for MGMT som en klinisk markør for potentiel effekt af kemoterapi i forbindelse med behandling af en specifik type hjernecancer (glioblastoma). Man har nemlig observeret, at når MGMT-promotoren ikke er metyleret (og MGMT-genet derfor kan aflæses effektivt), er kemoterapi-behandling ikke særlig effektiv i modsætning til, når MGMT-promoteren er metyleret (og MGMT-genet ikke kan aflæses). Mette Sørensen Thinggaard og hendes kollegaer ved SDU studerer i øjeblikket de mere generelle metyleringsmønstre i MGMT-genet i relation til ikke blot hjernecancer men også forskellige typer af aldersrelateret cancer.
Hvad er din metyleringsalder?
Vi har alle oplevet, at nogle mennesker virker ældre eller yngre end de egentlig er. En del af forklaringen kan som allerede antydet ligge i epigenetikken og forskellige metyleringsmønstre, som kan give ophav til varierende aldringstegn. Aldringsforskeren Steve Horvath har ligefrem udviklet en model, som kan forudsige en persons alder ud fra vedkommendes metyleringsmønster. Han udviklede modellen ud fra studier af 8000 metyleringsprøver fra 51 raske vævs- og celle-typer, og hver af disse prøver blev undersøgt for 480.000 CpG-positioner. Han søgte efter et sæt af CpG-positioner, der statistisk korrelerede stærkt med personernes faktiske alder.
Modellen, som han kom frem til, er baseret på metyleringen af ikke mindre end 353 CpG-specifikke positioner. Status for disse positioner definerer en “DNA-metyleringsalder”. Forskellen mellem DNA-metyleringsalderen og en persons faktiske alder kan derfor fungere som et mål for, hvor sund personens aldring er. Det vil sige, at hvis en person er ældre end personens metyleringsstatus beregnes til, så er der tale om sund aldring.
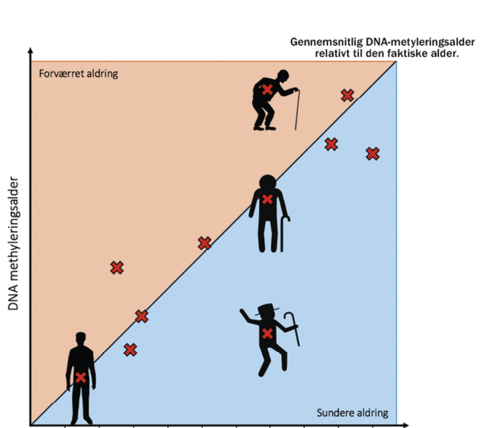
Studier af Horvaths DNA-metyleringsalder og lignende metyleringsaldre udviklet af andre forskere har efterfølgende kunne påvise statistiske korrelationer imellem høj DNA-metyleringsalder og flere forskellige aldersrelaterede sygdomme, førtidige aldringssyndromer samt livslængde.
Modellen har også vist sig nyttig i forhold til at identificere sygdomspræget væv. Eksempelvis viser vævsprøver med kræft højere DNA-metyleringsalder end den faktiske alder for individet. Det kan betegnes som alders-acceleration – vedkommende eller vævet fremstår ældre end forventet.
Kræftceller adskiller sig blandt andet fra andre celler ved, at de deler sig uhæmmet. Epigenetiske forandringer spiller muligvis en rolle i den proces, idet det som nævnt er epigenetikken, der dirigerer cellerne til at indtage deres specifikke roller til de forskellige væv i kroppen – og denne differentieringsproces menes at være forstyrret i kræftceller, hvilket blandt andet betyder, at kræftceller bibeholder evnen til at dele sig uhæmmet. En dybere forståelse af, hvordan epigenetiske forandringer kan ændre måden, cellerne opfører sig og spiller sammen på, kan derfor hjælpe til forståelsen af kræftudvikling og dermed give ideer til nye strategier for behandling af kræft.
Hjælp at hente fra kosten
Epigenetiske ændringer, herunder metyleringer, er som nævnt reversible – de kan altså “rulles” tilbage. Derfor er der stor interesse i at finde stoffer, som kan få kroppen til at gøre netop det og på den måde modvirke skadelige forandringer, som bidrager til sygdomsudvikling. Nogle forskere har blandt andet undersøgt forskellige stoffer, der findes naturligt i fødevarer for deres evne til at kunne blokere for DNA-metyltransferaser og dermed forhindre, at DNA bliver metyleret.
Studier af forbindelserne genistein og polyphenol (-)-epigallocatechin-3-gallate, som findes i soja og grøn te, har således vist, at tilstedeværelsen af disse stoffer medfører et fald i aktiviteten af DNA-metyltransferease og derved en aktivering af gener, som ellers var slukket på grund af metylering. Yderligere er der indenfor de seneste år begyndt at komme studier, hvor man undersøger, om kostændring kan forandre individers metyleringsalder. Disse studier er medvirkende til at afdække nogle af de mekanismer, hvormed kost kan forebygge progressionen af sygdomme som kræft og den generelle aldringsproces. ♦
Fædres fedme kan påvirke deres ufødte børn
Børn af overvægtige mænd har øget disponering for at blive overvægtige. Umiddelbart vil man tro, at dette enten skyldes en genetisk disponering for at blive overvægtig eller en påvirkning med uheldige spisevaner eller en kombination heraf. Men måske er der også epigenetik på spil.
Professor Romain Barrés og hans kollegaer fra Novo Nordisk Foundation Center for Basic Metabolic Research ved Københavns Universitet har sammenlignet sædceller fra overvægtige og slanke mænd og afsløret, at deres sædceller ser epigenetisk forskellige ud. Ændringerne var fremtrædende på gener, som blandt andet styrer appetitten. Det er derfor muligt, at faderens epigenetik påvirker børnenes regulering af appetit. Disse studier antyder altså, at vordende forældres livsstil i et eller andet omfang kan nedarves. De overvægtige fædre kan potentielt også give en øget risiko for autisme videre på samme måde, da de epigenetiske ændringer i sædcellerne også involverer gener, der er vigtige for hjernens udvikling.