Smitsomme svampe truer den globale sundhed
Sygdomsfremkaldende svampe er en potentiel trussel mod verdens fødevareproduktion. Især er det et problem, når sådanne svampe skifter fra at smitte én art til en anden, for så kan smitten lynhurtigt brede sig. Netop derfor forsøger danske forskere at undersøge, hvad der skal til, for at et sådant værtsskifte kan ske.
Af Kristian Sjøgren, videnskabsjournalist, ksjoegren@gmail.com
Hvis du har set HBO-serien The Last of Us, så kender du også præmissen for serien, nemlig at hele verden er blevet lagt i ruiner af en patogen svamp, der har fundet ud af at smitte mennesker og dræbt praktisk talt hele verdens befolkning.
Ja, TV-serien er science fiction, men faktisk har den hold i den virkelige verden. Der findes nemlig millioner af svampe i naturen, og de forsøger hele tiden at finde nye måder, hvorpå de kan inficere nye arter. Det gælder både i planteriget, i insekternes verden og blandt pattedyr. Nogle gange lykkes det svampene, og det kan have katastrofale konsekvenser for dyr, økosystemer og i sidste ende mennesker. Vi mennesker skal nok ikke frygte, at en patogen svamp gør os til zombier lige foreløbigt, men der er også andre måder, hvorved en patogen svamp kan lede til død og ødelæggelse blandt mennesker.
For eksempel eksisterer der den konstante trussel, at patogene svampe begynder at inficere nogle af de afgrøder, som mennesker er afhængige af. Sker det, kan et ukontrolleret udbrud af afgrødesygdom lede til fødevaremangel og hungersnød. Det skete blandt andet for omkring 170 år siden, da kartoffelhøsten slog fejl i fem år i træk på grund af en patogen oomycet (en svampelignende mikroorganisme) og blandt andet ledte til, at omkring en million irere døde af sult, mens yderligere en million emigrerede.
Ovenstående baggrund gør også, at der rundt omkring i verden bliver forsket intensivt i at forstå, hvad der skal til, før en patogen svamp kan springe fra at sprede død og ødelæggelse hos én art til også at kunne gøre det hos en anden. En af de forskere, der er med helt fremme i den forskning, er lektor Henrik Hjarvard de Fine Licht fra Institut for Plante- og Miljøvidenskab ved Københavns Universitet.
I hans laboratorium forsøger forskerne at kortlægge, hvordan en patogen svamp går gennem de forskellige trin i processen mod at kunne smitte et insekt, slå det ihjel og bryde ud gennem dets skal med nye sporer, der er klar til at smitte andre. Forskerne bruger blandt andet “eksperimentel evolution”, hvor de skaber nogle kontrollerede betingelser, som de kan studere de naturlige evolutionære processer under. Forståelsen af smittespredning mellem insekter skal gerne gøre forskerne klogere på nogle universelle mekanismer for patogene svampes evolution i overgangen mod at være en trussel mod nye arter.
»Vi kender kun alt for godt til virus, der springer fra en dyreart til en anden – og til også at kunne smitte mennesker. Det så vi med blandt andet COVID-19, der efter springet endte med at slå millioner af mennesker ihjel. Svampe udvikler sig ikke lige så hurtigt som virus, men de kan alligevel være farlige for mange af de dyr og planter, som vi er afhængige af. Derfor er det vigtigt at forstå, hvad der skal til, for at de skifter fra at smitte den ene vært til at smitte den anden,« forklarer Henrik Hjarvard de Fine Licht.
Når patogener udvider værtsspektret kan det gå galt
Patogener, der kan springe fra at sprede død og ødelæggelse hos én art til også at kunne gøre det hos en anden, er ikke kun begrænset til mennesker og andre pattedyr, men forekommer også blandt planter og insekter og kan have alvorlige konsekvenser for økosystemer, landbrug og sundhed. Kendte eksempler fra planteverdenen er for eksempel kartoffelskimmel, der er forårsaget af Phytophthora infestans, og den hollandske elmesyge som er forårsaget af Ophiostoma ulmi.
Kartoffelskimmel stammer oprindeligt fra Sydamerika, hvor den inficerede vilde slægtninge til kartoffelplanten. I det 19. århundrede blev kartoffelskimmel ved et uheld introduceret til Europa. Her blev kartoffelplanter, som ikke var resistente, inficeret, hvilket førte til den store irske kartoffelhungersnød fra 1845 til 1852. Katastrofen resulterede i millioner af dødsfald og massiv emigration fra Irland.
Den hollandske elmesyge forårsages af svampen O. ulmi, der oprindeligt kun inficerede nogle få træarter. I 1920'erne blev svampen spredt og begyndte at inficere europæiske og nordamerikanske elmetræer. Svampen har ødelagt millioner af elmetræer, hvilket har haft en betydelig økologisk og æstetisk indvirkning på landskabet.
Begge disse eksempler skyldes patogene svampe, der utilsigtet bliver spredt til nye geografiske områder. Her er svampene stødt på nye værtsarter, som ikke er i stand til modstå en infektion. Geografisk spredning er dog ikke altid nødvendigt for, at et patogen udvider værtsspektret.
Fra menneskets verden kan man finde mange patogener, der oprindeligt smittede andre arter, men tog springet til også at smitte mennesker (så kaldte zoonoser). Det gjaldt for eksempel HIV, der oprindeligt kun smittede chimpanser, fugleinfluenza, der menes at stå bag den spanske syge, og så selvfølgelig COVID-19.
Patogener: Sygdomsfremkaldende organismer
Når vi taler om patogener, taler vi om organismer, der kan smitte andre organismer, gøre dem syge og slå dem ihjel. Patogener kan man typisk opdele i virus, bakterier, svampe og parasitter. Et kendetegn ved patogener er også, at de ofte er meget selektive i, hvad de kan smitte, og hvad de ikke kan. Derfor kan mennesker – for det meste – ikke blive syge af patogener, der kan smitte aber, køer, hunde, fisk eller insekter. Dyrene kan heller ikke blive smittet med de patogener, der kan gøre os mennesker syge.
Årsagen til denne manglende evne til at smitte mellem arter er egentlig meget simpel. For at et patogen effektivt skal kunne smitte et menneske, skal de være tilpasset til netop at kunne trænge ind i vores celler gennem for eksempel receptorer på overfladen af dem og derefter inde i vores celler angribe eller overtage forskellige cellulære signalveje. Både receptorer på overfladen af vores celler og signalvejene i cellerne er unikke for hver art, og derfor kan som eksempel en bakterie, der kan udnytte en receptor på overfladen af en menneskecelle, ikke komme ind i cellerne hos en kat eller hund. Receptorerne til at inficere cellerne er der simpelthen ikke.
Ovenstående er dog en sandhed med modifikationer. Patogener udvikler sig nemlig hele tiden, og det vil sige, at et patogen, der kan smitte flagermus, chimpanser eller fugle, godt kan tilpasse sig evolutionært til også at kunne smitte mennesker. Lykkes det, kan resultatet være COVID-19, HIV eller fugleinfluenza.
Samme problematik er relevant blandt de patogene svampe, der inficerer insekter eller afgrøder. Her kan man for eksempel forestille sig et patogen, der som udgangspunkt kun kan smitte hvepse, udvikler evnen til at smitte honningbier, hvilket kan lede til massedød blandt en art, som er meget vigtigt for mere end bare produktionen af honning. Bier spiller også en essentiel rolle i bestøvningen af for eksempel frugttræer og buske. Taler vi om patogene svampe, der kan smitte planter, kan man frygte/forestille sig, at en svamp, der skaber død og ødelæggelse blandt specifikke vilde planter, udvikler evnen til at smitte hvede, ris eller majs.
»Problemet med de patogene svampe er også, at vi typisk først finder svampene, når de er problematiske og allerede har lært at smitte afgrøderne. Der er skiftet fra den ene vært til den anden sket, hvilket også betyder, at vi rent forskningsmæssigt kun kan se resultatet af værtsskiftet, men ikke hvordan det er sket. Hvis vi gerne vil kunne forudsige og forhindre, at patogene svampe springer fra den ene vært til en anden, eller i hvert fald være forberedte på det, kræver det, at vi har en bedre forståelse af de evolutionære processer og de trin, som patogenet skal igennem,« forklarer Henrik Hjarvard de Fine Licht.
Og så er vi fremme ved Henrik Hjarvard de Fine Lichts egen forskning. Den går nemlig ud på at forstå de patogenes svampes udvikling fra at være en trussel mod en art til også at være en trussel mod en anden. Henrik Hjarvard de Fine Licht laver sin forskning i insekter som et modelsystem, men opdagelserne er lige så relevante for afgrøder, som de er for græshopper, biller og bier.
Fordelene ved at lave forskningen i insekter er til gengæld, at deres livscyklus er meget hurtigere, og at forskerne kan have flere hundrede insekter i små kasser uden meget pleje. Ville de undersøge patogene svampes værtsskifte i afgrødeplanter, skulle de plante tusindvis af små planter, vente på at de voksede op og blev klar til at lave frø, som kunne blive til nye planter. Afhængigt af arten kan den proces tage flere måneder. Med insekter kan forskerne komme gennem hele livscyklussen på få uger.
I forskningsarbejdet inficerer Henrik Hjarvard de Fine Licht og kollegaer melbiller med en patogen svamp, som ellers kun smitter græshopper. De patogene svampe fungerer på den måde, at svampesporer lander på insektets krop, hvorefter de begynder at lave svampetråde (hyfer), som borer sig ned gennem insektets hårde skal. Når svampen er trængt gennem skallen, begynder svampen at vokse inde i insekterne, hvor de danner en masse nye svampeceller, som på et tidspunkt trænger ud gennem insektet, hvor de sætter sig som en masse sporer, som andre insekter kan komme i kontakt med og derved sprede smitten. Behøver jeg at skrive, at insekterne stiller træskoene på et tidspunkt undervejs i svampens destruktive hærgen?
I forsøgene laver forskerne først en unaturligt høj koncentration af svampesporer, som de smører på melbillerne. Det gør de under kontrollerede betingelser med blandt andet høj luftfugtighed, hvilket svampene godt kan lide. Efterfølgende holder de øje med, om nogle af billerne bliver inficeret med svampen, altså at springet fra den ene vært til den anden lykkes.
Eksperimentel evolution
Eksperimentel evolution er en videnskabelig metode, der bruges til at studere evolutionære processer i realtid ved at observere, hvordan organismer ændrer sig over mange generationer under kontrollerede forhold. Denne tilgang giver forskere mulighed for at teste hypoteser om naturlig selektion, mutationer, genetisk drift og andre evolutionære mekanismer ved at manipulere miljøet og observere de resulterende ændringer i populationer.
Et klassisk eksempel på eksperimentel evolution er Richard Lenskis langvarige eksperiment med colibakterier, som begyndte i 1988. Richard Lenski og hans kollegaer startede med 12 identiske populationer af colibakterier og har siden opretholdt disse populationer under konstante forhold, hvor bakterierne vokser og deler sig hurtigt. Ved at nedfryse prøver af populationerne over tid kan forskerne “genoplive” tidligere generationer og sammenligne dem med nyere generationer. Dette eksperiment har givet værdifulde indsigter i evolutionære processer, for eksempel hvordan bakterier udvikler nye metaboliske funktioner og tilpasser sig deres miljø over tusinder af generationer.
Eksperimentel evolution er ikke begrænset til mikroorganismer. Forskere har også anvendt metoden på andre organismer, både dyr og planter samt selv kunstige systemer som digitale organismer i computermodeller. Ved at udsætte populationer for forskellige selektionstryk, for eksempel ændringer i temperatur, tilgængeligheden af næringsstoffer eller tilstedeværelsen af rovdyr, kan forskere observere, hvordan populationer tilpasser sig, og hvilke genetiske ændringer der driver disse tilpasninger.
Forskere kan også undersøge, hvordan et patogen tilpasser sig til at kunne inficere en ny vært og derigennem springe fra at være farlig for én art til også at være det for en anden.
En af fordelene ved eksperimentel evolution er, at den gør det muligt at gentage forsøg og verificere resultater under kontrollerede betingelser. Dette adskiller den fra naturlige observationer af evolution, hvor miljøfaktorer ofte er komplekse og vanskelige at kontrollere. Eksperimentel evolution har derfor været afgørende for at forstå fundamentale principper i evolutionær biologi og for at teste teorier om, hvordan arter udvikler sig over tid.
Eksperimentel evolution
Henrik Hjarvard de Fine Licht fortæller, at hele skiftet fra at kunne inficere den ene vært til den anden foregår i trin. Først og fremmest skal svampe og insekter i det hele taget befinde sig i det samme geografiske område på samme tid. Det nytter som eksempel ikke noget, at et patogen i myg fra Alaska godt kan smitte fluer i Australien, for det er usandsynligt at de to arter vil komme i kontakt med hinanden.
For det andet skal svampen udvikle evne til overhovedet at trænge ind i det nye insekt, og det kræver, at den finder nye strategier for det, blandt andet at kunne identificere nye receptorer, der kan benyttes i angrebet. Så skal svampen tilpasse sig, så den kan leve i det nye insekt, og til sidst skal svampen udvikle en mekanisme til at kunne bryde ud gennem insektet igen og lave sporer, der kan smitte andre af samme type insekt.
Succesen af denne sidste del kan blandt andet være afhængig af biologiske forskelle mellem de to insektarter, som svampen springer imellem. Den ene art lever måske i store grupper, mens den anden lever mere som eremitter. Det har betydning for, hvor let det er at bringe smitte mellem de enkelte individer. Indenfor forskningen hedder den type forsøg “eksperimentel evolution”, hvor forskere skaber nogle kontrollerede betingelser.
»Vi har lige nu svampe, som vi har haft gennem 10 serielle passager, altså smitte fra det ene insekt af samme art til det andet og så videre. Det er et skridt på vejen, men 10 passager er i evolutionær sammenhæng stadig meget lidt. Samtidig kan vi dog se, at svampene bliver bedre og bedre til at smitte melbillerne. Det gør, at vi nu kan sammenligne hvert trin i udviklingsprocessen og se, hvad der er sket i svampen mellem hvert trin fra første til sidste trin, altså hvordan har svampen tilpasset sig? Det gør vi ved både at undersøge svampenes fysiologi, genetik og epigenetik« siger Henrik Hjarvard de Fine Licht.
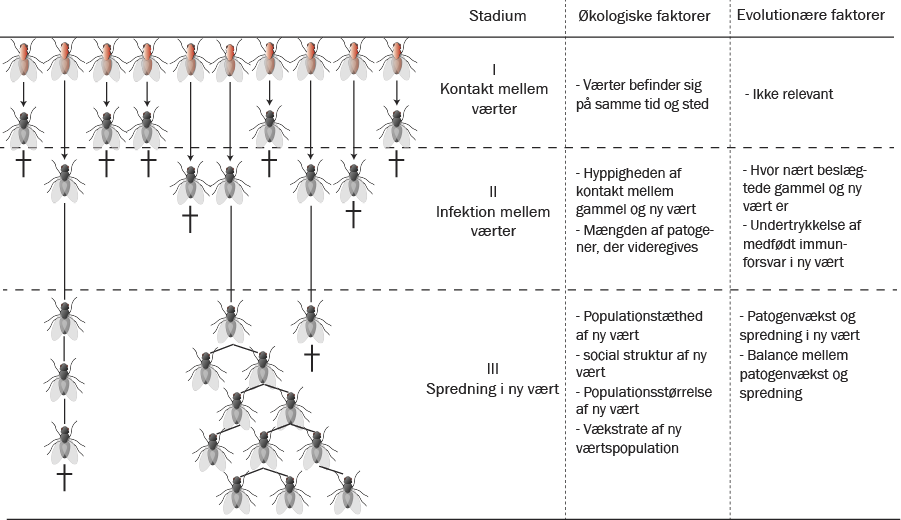
Stadier i et værtsskift. Skematisk oversigt af et patogen, der naturligt inficerer røde fluer, men kommer i kontakt med en ny vært, mørkegrå fluer. Hvis patogenet ikke kan inficere den nye vært, vil det dø ud allerede i det første stadie, her vist med et kors. Hvis patogenet kan inficere den nye vært, men ikke kan fortsætte sin spredning i den nye vært, vil den dø ud i andet stadie. Til højre er vist eksempler på relevante økologiske og evolutionære faktorer for de tre stadier.
Han uddyber, at vi i dag og i fremtiden ser og vil se mange flere skifte i værts-organismer for forskellige patogener, fordi vi mennesker har skabt en verden, hvor både insekter og afgrøder bliver flyttet rundt på kloden med en rasende fart. Det betyder, at de økologiske barrierer som tid og sted bliver nedbrudt og muliggør værtskifte, der ikke var mulige før i tiden.
»Vi vil gerne blive klogere på, hvad der kræves i de enkelte trin i udviklingen. Skal svampene udvikle nogle helt bestemte mutationer, og vi derfor ser de samme mutationer i alle de svampe, som vi arbejder med, eller kan de udvikle forskellige måder til at smitte melbillerne på?« siger Henrik Hjarvard de Fine Licht.
Truslen fra svampe
Det samlede forskningsarbejde skal gerne udmunde i en bedre forståelse af, hvad det kræver for patogene svampe at lave et værtsskifte. Formålet er både at blive klogere på mekanismerne på det grundvidenskabelige niveau, men også at kunne forudsige det i fremtiden og på den måde være på forkant, inden en patogen svamp lægger hele verdens produktion af hvede eller majs ned.
Den samlede viden kommer også til at være relevant i fremtiden, hvor blandt andet klimaforandringer kommer til at skabe nye og måske mere gunstige betingelser for svampe, der er på jagt efter nye værter at inficere. I takt med, at klimaforandringerne tager mere og mere fat, er forskere ret overbeviste om, at det vil skabe flere afgrødesygdomme, som kan være en trussel mod den globale fødevaresituation. På den anden side af mønten ønsker flere og flere mere økologisk fødevareproduktion med mindre forbrug af pesticider til blandt andet at bekæmpe patogene svampe. Større risiko for spredning af patogene svampe rimer dårligt på mindre forbrug af pesticider.
»De seneste år er vi blevet opmærksomme på, hvor hurtigt evolutionen kan gå, og hvor hurtig nye patogene arter enten direkte eller indirekte kan true menneskers helbred. Vi er nødt til få en bedre forståelse af, hvordan patogener bliver til en trussel mod os ved at skifte vært. Derudover står vi også med et andet problem, og det er, at svampe, ligesom bakterier, udvikler resistens mod de midler, som vi har til at bekæmpe dem med. Netop når det kommer til svampemidlerne, benytter vi faktisk ofte de samme midler til at bekæmpe svampe i afgrøder, som vi bruger i mennesker. Det betyder, at der altid er en risiko for, at hvis en patogen svamp begynder at smitte mennesker eller livsvigtige afgrøder, kan vi stå i en situation, hvor vi ikke har noget effektivt at bekæmpe den med,« siger Henrik Hjarvard de Fine Licht. ♦