Liv baseret på silicium i stedet for kulstof – en død sild
Grundstoffet silicium ligner kulstof på flere måder, og det har fået forskere til at spekulere over, om liv på fjerne planeter kunne være baseret på silicium i stedet for kulstof som her på Jorden. Hvorfor det i praksis ikke kan lade sig gøre, får vi forklaringen på her.
Af Kai Finster og Niels Iver Winstrup Nielsen
Vores søgen efter liv udenfor Jorden har nået nye højder. Rumbaserede teleskoper som Hubble, Kepler og TESS gør det muligt at finde planeter om andre stjerner og nyeste estimater anslår, at mange af disse planeter er jordlignende og kredser om sollignende stjerner.
Dermed ligger det implicit i kortene, at der er en ret stor sandsynlighed for, at der findes liv udenfor for Jorden. Det er derfor nærliggende at spørge: Hvordan kan vi finde ud af, om der er liv på disse planeter, og om det ligner jordisk liv?
Når forskerne leder efter liv i rummet, er det i sagens natur liv, der minder om jordisk liv, da det jo er den eneste slags liv, vi kender. Det er altså liv, som i hovedsagen er opbygget af kulstofatomer, som vi kender det fra for eksempel DNA‚ proteiner, fedtstof og kulhydrater. I vores egen krop er det kun knogler og tænder, som ikke består af kulstof. Det store spørgsmål er, om det også gælder det liv, man måske kan finde i rummet. Kunne man forestille sig liv baseret på andre grundstoffer end kulstof? Det grundstof, som oftest nævnes som en mulighed, er silicium, da det er det grundstof, der har flest træk tilfælles med kulstof. I denne artikel vil vi se på, om liv i lighed med det, vi finder på Jorden, men baseret på silicium i stedet for kulstof, nu også er en realistisk mulighed.
Ligheder og forskelle mellem kulstof og silicium
Kulstof har mange fremragende egenskaber som “livets byggesten”. Kulstofatomer kan danne et hav af kæder, forgrenede kæder og ringe, som vi kender fra for eksempel fedtstoffer og kulhydrater. Molekylerne er forholdsvis stabile uden at være “for” stabile. Det vil sige, at det kræver en “passende” energimængde at bryde bindingerne. Hvis bindingsenergien var meget mindre, ville de kemiske forbindelser for eksempel let kunne selvantænde, mens for stor en bindingsenergi ville betyde, at de kemiske forbindelser ikke ville kunne reagere.
Et oplagt alternativ til kulstof kunne være silicium, der står lige under kulstof i det periodiske system. Begge atomer har fire elektroner i den yderste skal og kan derfor danne fire bindinger med andre atomer. De kan begge danne kæder og ringe, men selv om dette er nødvendigt, er det ikke tilstrækkeligt for at kunne danne mere komplicerede biologiske molekyler. Hvorfor?
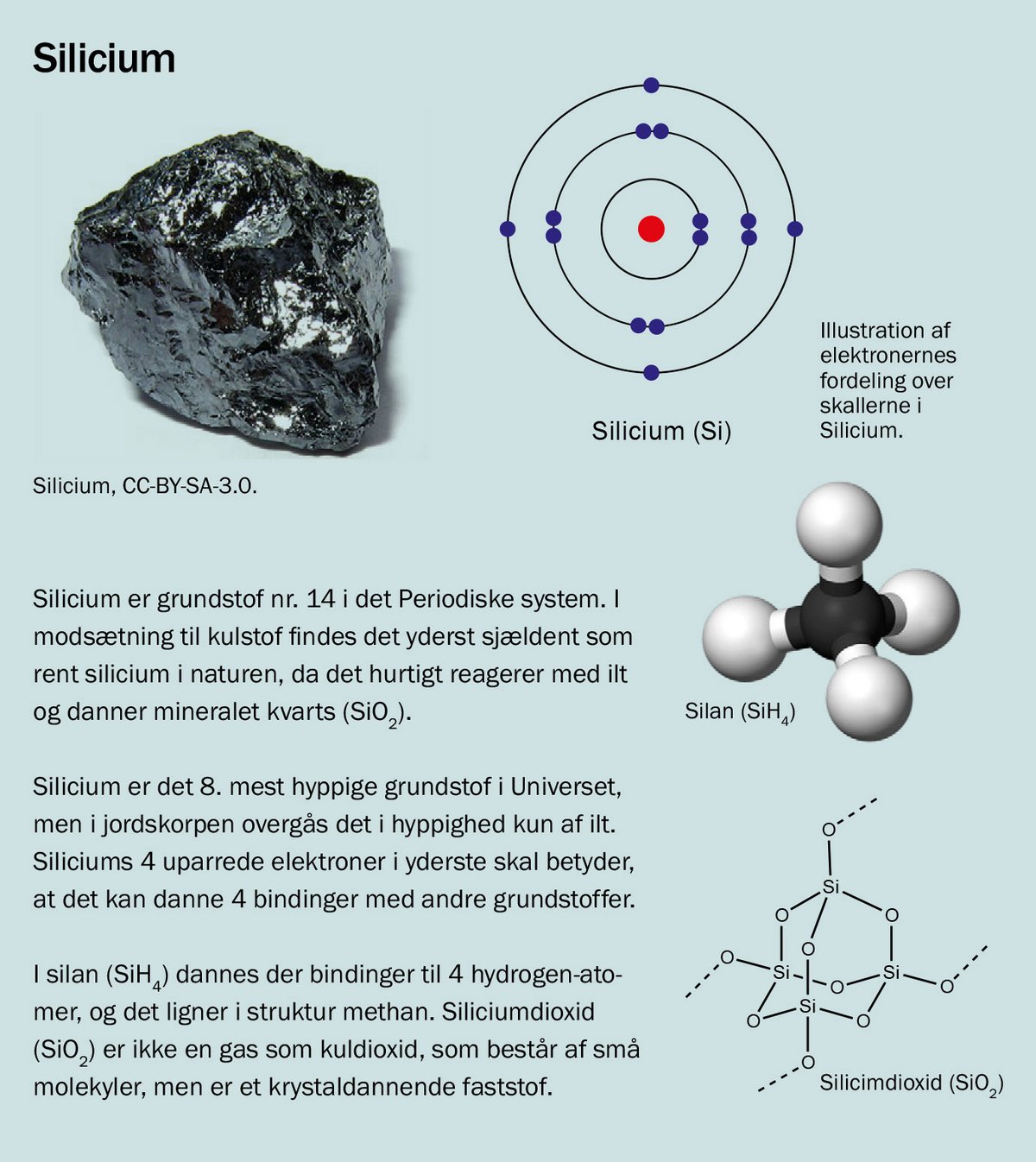
Den afgørende forskel på kulstof og silicium ligger i, at hvor de 4 elektroner i kulstof befinder sig i atomets 2. skal, befinder de sig for siliciums vedkommende i 3. skal. Silicium har således en radius på 210 pm (picometer), mens kulstof har en radius på 170 pm (en picometer er en milliardte del af en millimeter). Forskellen i størrelse har afgørende betydning for styrken af de bindinger og bindingstyper, silicium kan indgå i.
Sigma- og Pi - bindinger

Liv og dobbeltbindinger
Kulstof kan danne en dobbeltbinding til andre kulstofatomer og til for eksempel nitrogen- og oxygenatomer. En dobbeltbinding består af to bindingstyper, der traditionelt kaldes for henholdsvis en sigma-binding og en pi-binding (ofte blot angivet med det græske bogstav for henholdsvis sigma og pi, det vil sige σ-binding og π-binding). I sigma-bindingen befinder de to elektroner sig i en sky symmetrisk omkring en akse imellem de to atomer. I pi-bindingen danner de to elektroner en sky, der ligger noget længere væk og som minder lidt om burgerbolle.
Her er så en afgørende forskel: Silicium kan kun danne sigma-bindinger og ikke pi-bindingen, og derfor kan silicium ikke danne dobbeltbindinger. Dette skyldes, at afstanden imellem de elektroner, der skal danne pi-bindingen, simpelthen er for stor, da bindingen skal dannes af elektroner fra 3. skal.
En dobbeltbinding resulterer i en “fastlåsning” af molekylet omkring dobbeltbindingen, og flere dobbeltbindinger i et molekyle er derfor med til at give det en bestemt geometrisk form, hvilket har biologisk betydning. Det betyder, at mere komplicerede biologiske molekyler med dobbeltbindinger, som spiller en væsentlig rolle i organismernes stofskifte, ikke kan dannes med siliciumatomer.
Så selvom silicium kan danne kæder og ringe, er disse for simple til at skabe biologisk aktive molekyler. Kulstofs bindinger til nitrogen og ilt er vigtige ved dannelse af aminosyrerne, som er byggesten i proteiner. Her kan et enkelt kulstofatom erstattes med silicium, men resten skal stadig være kulstof, specielt kan kulstof i den del af molekylet, der karakteriserer en aminosyre, ikke erstattes.
Når Fri ilt og siliciumbaseret liv er en krudttønde
Da elektronerne i den yderste skal i siliciumatomet er en lille smule længere væk fra atomkernen, end det er tilfældet for kulstof, har disse elektroner lettere ved at deltage i kemiske reaktioner. Det har stor betydning for stabiliteten af siliciumforbindelser i en atmosfære, der indeholder cirka 20 % ilt, som det er tilfældet på Jorden i dag.
Hvis vi sammenligner de to mest simple kulstof- og siliciumforbindelser – metan (CH4) og silan (SiH4) – så er metan stabil ved stuetemperatur, og der skal tilføres energi i form af for eksempel en gnist for at antænde metanen. Derimod antændes silan spontant ved stuetemperatur i en atmosfære som på Jorden. Det gælder for alle silaner op til en kædelængde på 7 siliciumatomer. Med andre ord: I en verden, der indeholder fri ilt, vil silicium-baseret liv leve i en krudttønde.
Kuldioxid eller sand – det er spørgsmålet
Som bekendt er kuldioxid (CO2) udgangs- og endepunkt for livets processer. Bakterier eller planter opsamler kuldioxid (CO2) fra atmosfæren, og i en kompleks biokemisk proces, som oftest involverer sollys og vand, omdannes dette til kulhydrater, som er udgangsmateriale for alle de andre kulstofmolekyler, der findes i en organisme.
6CO2 +6H2O + energi → C6H12O6 +6O2
I organismernes metabolisme bliver kulhydraterne forbrændt, og kuldioxid og vand frigjort.
C6H12O6 +6O2 → 6CO2 +6H2O + energi
Samtidig frigives energi, som kan bruges til at danne nye kulstofmolekyler eller til at udføre et arbejde. CO2 og vand kan genbruges i en ny omgang fotosyntese.
Hvordan vil det se ud ved siliciumbaseret liv? I stedet for at optage og afgive CO2 skulle organismen optage og afgive siliciumdioxid (SiO2), som vi også kalder kvarts, og som ofte udgør hovedparten af sand. Her er “problemet”, at kvarts er et fast stof med en meget stabil struktur, som derfor er meget svært at omdanne. Dette afspejler sig for eksempel i, at det først koger ved en temperatur på 2230°C.
Silicium dur ikke som kulstoferstatning i liv
De egenskaber ved silicium, vi har beskrevet her: manglende evne til at kunne danne dobbeltbindinger, at simple siliciumforbindelser selvantænder ved stuetemperatur samt et mineral som udgangs- og slutprodukt i metabolismen, gør det umuligt at forestille sig et silicium-baseret liv som et alternativ til kulstofbaseret liv. Skulle man finde tegn på liv på andre planeter, kan dette derfor ikke være baseret på silicium. ♦