Hjernens blå prik – centrum for hjernens sundhed?
Et lille område af hjernen bestående af nogle få tusinde neuroner kaldet Locus Coeruleus har formentlig stor betydning for hjernens funktion og sundhed. Derfor er forskerne meget interesserede i at undersøge funktionen af dette område nærmere, hvilket dog er en udfordring.
Af Nanna Bertin Markussen, Rasmus West Knopper og Brian Hansen
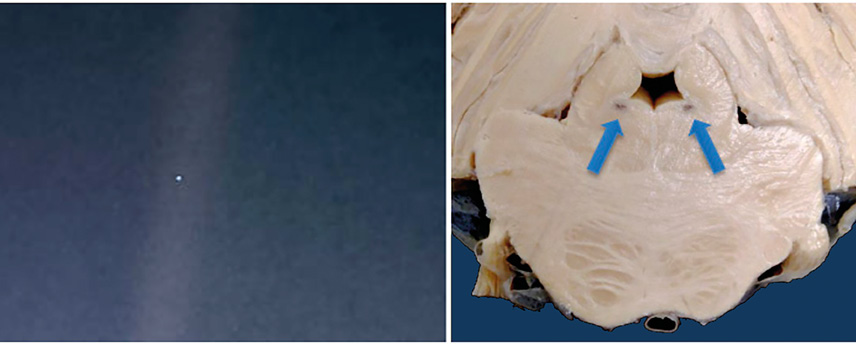
Et berømt billede fra rumsonden Voyager 1 viser jorden som en lille, blålig prik i universets store øde. Det er svimlende at tænke på: Fra en afstand af seks milliarder kilometer er rammen for hele den menneskelige historie et isoleret, blåligt fnug. Kigger vi indad gentager dette svimlende sig: dybt i hjernen findes en lille blålig kerne bestående af blot få tusinde neuroner (nerveceller), og denne samling neuroner menes i dag at have central funktion for hele hjernens virkning og sundhed.
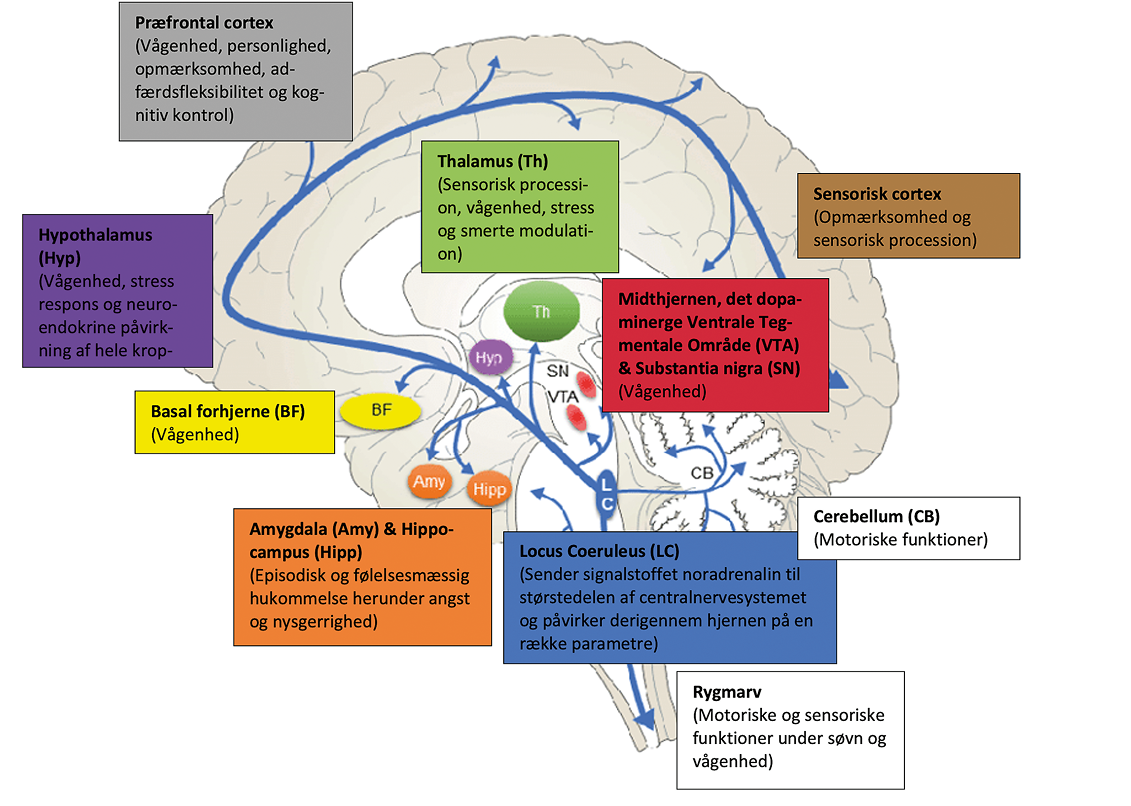
Kernen hedder Locus Coeruleus (egentligt fra det latinske Locus Caeruleus [udtales lokus særuleus], som betyder det mørkeblå sted, herfra blot LC) og er det primære sted for produktion af signalstoffet noradrenalin i centralnervesystemet. Via dette signalstof øver denne lille klynge af neuroner stor indflydelse på hjernens milliarder af andre neuroner. LC er at finde på begge sider af hjernestammen, som blandt andet også indeholder vejrtrækningscenteret. I et evolutionært perspektiv er hjernestammen en af de ældste dele af hjernen og danner rammen for fundamentale, livsnødvendige funktioner. Det forhold, at LC evolutionært set er gammel, medfører, at hjernens nyere strukturer alle er udviklet under indflydelse fra LC.
Set i dette perspektiv er den tilsyneladende ubalance mellem LC’s størrelse og dens indflydelse ikke så underlig. I den nutidige hjerne kommunikerer LC ved hjælp af noradrenalin til størstedelen af hjernen og påvirker derfor for eksempel vores søvnmønster, vores frygt og kæmp-eller-flygt-respons (via amygdala) og hukommelsen (via hippocampus). På basalt fysiologisk niveau menes LC at påvirke de små blodkar i størstedelen af hjernen. Disse kar er centrale for forsyning af næring til hjernevævet, og taber de funktion, tager vævet skade. Derfor mener man i dag, at beskadigelse af LC på langt sigt bidrager til udviklingen af neurodegenerative sygdomme som Alzheimers og Parkinsons sygdom.
Det er også interessant, at forskning tyder på, at søvn er hjernens rengøringstid, hvor affaldsstoffer udvaskes via det såkaldte glymfatiske system. Hvis det er korrekt, kan beskadigelse af LC føre til dårligere søvn og dermed dårligere rengøring af hjernen med ophobning af skadelige affaldsstoffer til følge. Dette sker i så fald sideløbende med tabt funktion af små blodkar i hjernen, hvorved vævet altså både kommer til at mangle næring og rengøring.
Det er stadig uvist, præcist hvilke mekanismer der fører til udviklingen af neurodegenerative sygdomme. Interessant er det dog, at patienter med demens ofte har udviklet søvnforstyrrelser 10-15 år tidligere end demensdiagnosen stilles, og at LC ofte er den første hjernestruktur, der ses beskadiget.
Dette passer godt med de ovenfor beskrevne mekanismer. Forskningen søger i dag at identificere centrale mekanismer, som effektivt kan rammes med tidlig, forebyggende behandling. I håb om at bidrage hertil har vi i vores projekter fokus på at forstå LC’s rolle for hjernens funktion og sundhed.
Studier af hjernefunktioner
Historisk har man opnået indsigt i hjerneområders funktion ved at studere patienter med hjerneskader. Et berømt eksempel er jernbanearbejderen Phineas Gage, der overlevede at få en jernstang gennem den forreste del af hjernen, men hans personlighed var for altid forandret. Et andet eksempel er epileptikeren Henry Molaison, som fik fjernet hippocampus i et forsøg på at helbrede hans epilepsi og derved mistede evnen til at danne nye minder.
Ved observation of disse tilfælde sluttede man sig til de første indsigter om funktionen af frontallapperne (personlighed og social adfærd) og hippocampus (hukommelse). Samme strategi kunne i princippet anvendes på forsøgsdyr som mus, men i praksis er det umuligt at begrænse et kirurgisk indgreb til kun at beskadige et så lille og specifikt hjerneområde som LC, der både er diffus og placeret dybt i hjernen, uden at ødelægge andet hjernevæv. Derved ville en eventuel observeret effekt ikke isoleret kunne tilskrives LC. Som løsning har man derfor udviklet mere raffinerede metoder til at påvirke og undersøge funktionen af hjerneområder i mus. Vi vil her beskrive to metoder, som vi benytter i vores forsøg til at undersøge LC’s funktion i mus.
Mus og hjerneforskning
Når man skal studere en hjernestruktur som Locus Coeruleus (LC), er det helt afgørende at kunne udføre forsøg, hvor LC kan manipuleres alene og kontrolleret. Sådanne studier kan kun udføres i forsøgsdyr som mus, da man her kan påvirke LC i en intakt, levende organisme og undersøge effekten på en række parametre for adfærd og fysiologi. Ulempen ved at bruge forsøgsdyr er, at man ikke kan være sikker på, at resultaterne direkte kan overføres på mennesker.
Men der er også mange fordele. Et menneskes udvikling bestemmes af både arv og miljø, som man i undersøgelser hverkan kan ændre eller kontrollere. Derimod er forsøgsmus' genetiske baggrund kendt i stor detalje, og det er muligt at kontrollere det miljø, de lever i meget detaljeret – hvad de får at spise og drikke, hvad de har til rådighed, og hvordan deres døgnrytme er. At både arv og miljø er ens for alle dyrene, giver et optimalt grundlag for at sammenligne grupper af dyr, som påvirkes på forskellige måder i forsøget. Dertil kommer, at mus er pattedyr ligesom mennesket, og så har de en kort livscyklus, der gør det muligt at observere ændringer over en kort periode, der i mennesket først vil finde sted over flere årtier. Dette er specielt vigtigt, når man undersøger neurodegenerative sygdomme, der i mennesket oftest udvikles gradvist over mange år.
Ødelæggelse af LC
Det er muligt at ødelægge LC alene (en såkaldt ablation) ved at indsprøjte en nervegift (et neurotoxin), som kun rammer LC’s neuroner. I vore studier bruger vi neurotoxinet DSP-4, som indsprøjtes i musens bug, hvorfra stoffet optages i blodbanen, krydser blod-hjerne-barrieren og optages og ophobes i LC’s neuroner, som derved ødelægges. I vore studier er vi interesseret i at studere, hvad der sker i musehjernen, når LC er ude af funktion over lang tid.
For at kunne studere dette med MR-skanning og optisk mikroskopi skal vi først finde den optimale dosis nervegift. Det gør vi ved at indgive grupper af mus forskellige doser af giftstoffet og derpå undersøge størrelsen af LC samt antallet af neuroner. For at gøre dette aflives musen, og hjernen udtages og skæres derefter i tynde skiver. Dernæst farves hjerneskiverne med det formål at få LC til at skille sig ud fra resten af hjernevævet. I vores tilfælde opnår vi en selektiv farvning af LC ved at binde antistoffer til enzymet tyrosin hydroxylase, der er en vigtig del af dannelsen af det noradrenalin, som specielt er at finde i LC. Når hjernevævet er farvet, kan vi tælle antallet af celler og måle volumen af LC, der begge forventes at være formindsket. Graden af formindskelse giver et direkte udtryk for, hvor effektivt giften ødelægger LC ved den givne dosis. Herved kan vi finde den optimale dosis nervegift til vores fremtidige studier.
Studier af adfærd og fysiologi
Når den optimale dosis til at ødelægge LC er bestemt, indgives denne dosis i nye grupper af dyr, som derefter studeres indgående. I vores studier laver vi ikke-invasive søvn- og adfærdsstudier, MR-skanning og slutteligt optisk mikroskopi for at undersøge hjernens blodforsyning. Et vigtigt aspekt af vores studier er, at forsøgsdyrenes adfærd følges gennem forsøget, og at disse data indsamles på de samme dyr, som vi senere laver avancerede fysiologiske målinger på. Herved indsamles et datasæt, som giver et meget komplet indblik i effekten af manglende LC-funktion. På grund af LC’s indflydelse på stort set hele hjernen forventer vi at se ændret adfærd i de mus, der har fået beskadiget LC.
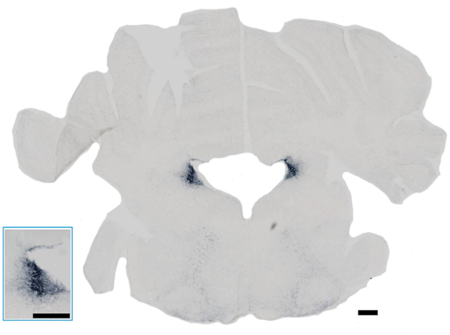
Snit af en musehjerne, der viser hjernevæv indeholdende Locus Coeruleus (LC), der ses farvet blå som en diffus klynge på hver side af det hvide område i midten. I mus er LC ikke blå som i mennesker, så derfor farves den, så cellerne kan tælles. Det indsatte billede nederst til venstre viser en forstørrelse af LC i snittets venstre side. I begge tilfælde svarer den sorte bjælke til 300 µm.
For eksempel ved vi, at LC sender signaler til hippocampus, så ved skade på LC forventer vi at se nedsat indlæring og hukommelse (som hos Henry Molaison nævnt ovenfor), hvilket kan undersøges ved brug af adfærdstests (se faktaboks). Derudover aktiverer LC hjernestrukturen amygdala, som har stor indflydelse på frygt og angst, hvilket også kan undersøges med adfærdstests. Ved skade på LC forventer vi derfor at se et nedsat angstniveau og en øget nysgerrighed.
Vores igangværende studier viser da også en tendens til, at kontrolgruppen med intakt LC har et højere angst- og frygtniveau samt er mindre nysgerrige end de tre grupper, der har modtaget forskellige doser af nervegiften. Denne observerede tendens til ændret adfærd er interessant, fordi mennesker, der lider af neurodegenerative sygdomme, er kendetegnet ved at have ændret hukommelse, indlæring, angst, nysgerrighed og søvn. Dette tyder på, at vores dyremodel kan lære os nye ting om LC’s rolle i disse sygdomme.
Adfærdstest af mus
Når man vil teste læring og hukommelse hos mus, kan man benytte adfærdstesten Barnes maze. Til undersøgelse af angst samt nysgerrighed kan adfærdstesten light-dark box benyttes. Begge adfærdstests bygger på, at musen søger at undgå store, lyse og åbne områder og foretrækker små, lukkede og mørke områder. Barnes maze består af en længerevarende træning, hvor musene oplæres i brugen af visuelle ledetråde til at finde det rigtige hul ud af tyve, hvor der er en lukket, mørk boks under. Hvor længe musen skal bruge på at lære, samt hvor god musen er til at huske, hvor boksen er, giver et indblik i musens indlæringsevner samt dens kort- og langtidshukommelse.
Adfærdstesten light-dark box adskiller sig ved, at den kun udføres én gang og ikke indebærer træning. Testen består af en rektangulær kasse med to områder – et mørkt og et lyst, der er forbundet med en lille dør. Musen placeres i det lyse og åbne område, hvorefter den får ti minutter til at udforske de to områder. Musens adfærd kan da vurderes ud fra en række parametre: Hvor den tilbringer mest tid, hvor hurtigt og langt den bevæger sig, og hvor mange gange den går fra det ene område til det andet. Disse parametre giver et udtryk for musens niveau af angst og nysgerrighed.
Resultater
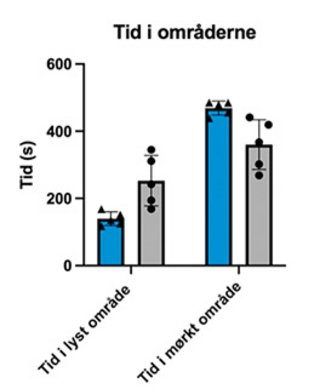
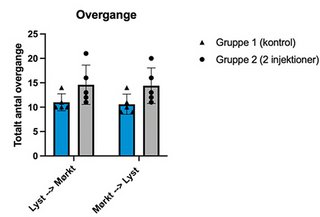
De to grafer viser resultater fra adfærdstesten light-dark box (se også faktaboks om adfærdstest). Her ses henholdsvis mængden af tid, musene bruger i hvert område (øverst) samt antal overgange fra det ene område til det andet (nederst). I hver graf vises resultater fra to grupper mus: gruppe 1, kontrolgruppen, har ikke fået injektioner med neurotoxin, der ødelægger Locus Coeruleus, mens gruppe 2 har fået to injektioner. Der ses en tendens til, at gruppe 1 har tilbragt mest tid i det mørke område sammenlignet med gruppe 2.
Det tyder på, at gruppe 2 har nedsat aktivering af amygdala. Årsagen til dette kan være manglende aktivering af amygdala fra Locus Coeruleus. Musene i gruppe 2 udviser dermed ikke samme angstniveau, der normalt medfører en adfærd, hvor musen helst vil opholde sig i det mørke område. Samtidig ses der en øget nysgerrighed, da gruppe 2 har flere overgange fra det ene område til det andet. I hver gruppe er der fem mus, og stregerne over søjlerne viser standardafvigelser. I vores studie har vi flere grupper end de to viste for også at kortlægge effekten af dosisstørrelse.
Billeder af hjernens aktivitetsmønster
Hvis LC spiller en vigtig rolle i udviklingen af neurodegenerative sygdomme, er det dog også vigtigt at tage hensyn til, at LC i disse patienter først sent og gradvist taber funktion. Den kemiske ødelæggelse af LC beskrevet ovenfor er derfor ikke altid den bedst egnede undersøgelsesmetode. De akutte effekter af en beskadiget LC kan undersøges via såkaldt optogenetik (se faktaboks) uden permanent at ødelægge hjernestrukturen. Denne metode bruger genetisk manipulation til at indsætte lysfølsomme proteiner på overfladen af udvalgte neuroner for eksempel i LC. Ved at lyse på proteinerne med en optisk fiber kan proteinerne åbnes, hvorved neuronet enten aktiveres eller undertrykkes afhængigt af proteinets egenskaber. Derved kan man tænde eller slukke et hjerneområde som ved brug af en lyskontakt.
Neuronerne i LC indeholder som nævnt enzymet tyrosin hydroxylase, og vi kan bruge dette karaktertræk til at rette de lysfølsomme proteiners egenskaber kun mod netop disse neuroner. På den måde vil kun celler med tyrosin hydroxylase i LC blive aktiveret af lyset.
Et tidligere studie har benyttet optogenetik til at undertrykke specifikke nervebaner mellem LC og hippocampus, hvilket resulterede i forringet indlæring. Studiet kombinerede optogenetik med mikroskopi og kunne vise, at LC reaktiverer specifikke hukommelsesceller i hippocampus. Hvis ikke det sker, reduceres indlæringsevnen. Derfor forventer vi også, at mus med ødelagt LC i vores nye forsøg vil klare sig dårligere i adfærdstests, der tester hukommelse og indlæring. Optogenetikkens evne til at tænde og slukke veldefinerede hjerneområder gør os således i stand til at se effekten af LC på andre hjerneområder, for eksempel hukommelsescellerne i hippocampus. Med sådanne teknikker øges vores evne til at afsøge funktionen af hjernens kredsløb, lidt ligesom man gør med et elektronisk kredsløb, man ønsker at forstå eller reparere.
Sådan fungerer optogenetik

Optogenetik går grundlæggende ud på at indsætte lysfølsomme proteiner (såkaldte rhodopsiner) i cellevæggen af neuroner, som i dette tilfælde er neuroner i Locus Coeruleus. Rhodopsinerne belyses og aktiveres herefter med en indopereret lysleder. I praksis kan indsættelsen af de lysfølsomme proteiner foregå ved hjælp af virus. Virussens genetiske materiale er organiseret i en lille, cirkulær DNA-sekvens kaldet plasmid. Alle de nødvendige gener for leveringen af lysfølsomme proteiner til LC indsættes i virussens plasmid, hvorefter virus injiceres ind i området omkring LC. I neuroforskning bruger man ofte en såkaldt adenoassocieret virus (AAV), fordi disse har stærke præferencer for neuroner, og fordi denne type virus ikke integrerer deres genetiske materiale i modtagercellens arvemateriale, hvilket ellers kan påvirke aflæsningen af cellens DNA.
Udover selve genet for rhodopsin indsætter man også et promoter-gen i plasmidet. Promoteren sikrer, at kun neuroner med visse karaktertræk kan aflæse genet for rhodopsin. Dette sker ved, at enzymet RNA-polymerase binder sig til promoteren og aflæser det efterfølgende DNA-stykke.
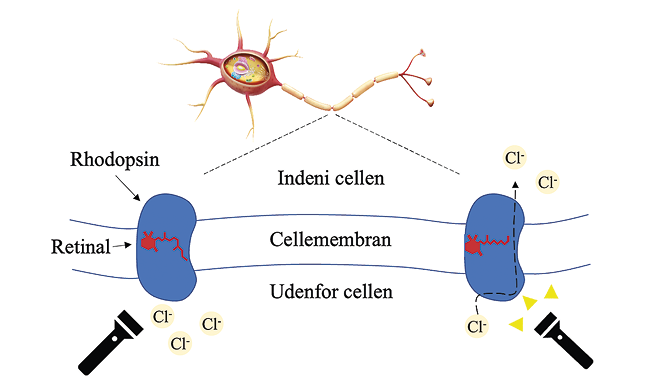
Efter succesfuld aflæsning af virussens DNA integreres det funktionelle protein (opsin) i neuronets membran. Herefter bindes lysabsorberende retinal til opsinet og danner det lysfølsomme rhodopsin-molekyle. I hvile er miljøet indeni cellen mere negativt ladet end udenfor cellen. Når neuronet aktiveres, bliver miljøet indeni cellen mere positivt ladet end udenfor cellen. Rhodopsiner kan modvirke denne celleaktivering, da de transporterer negativt ladede ioner som klorid (Cl-) ind i cellen eller positivt ladede ioner ud af cellen. Med optogenetik kan vi derfor undertrykke aktiveringen af LC og undersøge, hvilken effekt det har på hjernens blodkar.
I et af vores nye studier vil vi skanne mus med magnetisk resonans (MR), mens vi tænder og slukker LC ved hjælp af optogenetik. Baggrunden for dette forsøg er, at kognitiv svækkelse ofte er en forudgående diagnose til Alzheimers sygdom hos mennesker. MR-skanninger har vist, at disse patienter er karakteriseret ved at have et ændret aktiveringsmønster i hjernen, når patienten ikke fokuserer på noget specifikt (dette kaldes grundtilstandsnetværket). Hjernens grundtilstandsnetværk kan visualiseres ved hjælp af en MR-skanner, hvor man måler blodtilførsel og iltningsgrad i forskellige områder af hjernen, mens hjernen er i hvile. Vi vil undersøge, om en optogenetisk slukket LC fører til en ændring i musens grundtilstandsnetværk, som ligner det, man ser i mennesker med mild kognitiv svækkelse. Det smarte er, at vi på skift kan danne billeder af musens grundtilstandsnetværk med tændt/slukket LC i samme mus og under samme skanningssession.
Kombinationen af optogenetik og billeddannelse med MR-skanner kan således give os en idé om, hvorfor grundtilstandsnetværket er forstyrret hos mennesker med tidlig Parkinsons sygdom og samtidig belyse, hvorvidt en dysfunktionel LC kan være relateret til Alzheimers sygdom.
Håb om tidligere diagnose
I Danmark lider cirka 80.000 mennesker af neurodegenerative sygdomme. Alzheimers sygdom alene indtager femtepladsen på listen over de hyppigste dødsårsager i den vestlige verden. Aktuelt findes kun symptombehandlende medicin. Da sygdommenes udløsende faktorer er mange og opstår i et komplekst samspil over årtier, er det en stor udfordring at udvikle forebyggende behandlinger. Vi håber, at vores studier af LC i mus vil give indsigt, der kan bidrage med vigtig viden om sygdomsmekanismer og -udvikling og derved føre til udviklingen af tidligere og mere præcis diagnostik af patienter, så behandling kan startes tidligere og sikre patienten flere gode leveår.
Forhåbentligt kan denne type forskning også på sigt hjælpe til at identificere personer med risiko for udvikling af neurodegenerative sygdomme. Et af de spændende aspekter af vores forskning er, hvorvidt søvnobservation og hjerneskanninger kan bruges til at forudsige eller diagnosticere neurodegenerative sygdomme, inden de klassiske symptomer opstår. Hvis dette er tilfældet, giver det også mulighed for at begynde behandling tidligere. ♦