Blærebetændelse:
Sådan skjuler bakterierne sig i din krop
Bliver din blærebetændelse ved med at komme tilbage, selvom du har prøvet alt for at slippe af med den? En gruppe studerende fra Roskilde Universitet har undersøgt, hvordan og hvorfor bakterier er så gode til at overleve i blæren, selv efter utallige antibiotikabehandlinger.
Af Susanne Enig, Soffie Marie S. B. Pedersen, Nynne Emilie Nielsen, Line E. R. Sadolin og Maj Kamille M. Nielsen.
Mange af os har prøvet det: Det føles som om, du skal tisse hele tiden, og når du gør, føles det som at tisse nåle. Det er blot nogle af de ubehagelige symptomer, man kan have under en urinvejsinfektion, og hvis du har oplevet det, er du bestemt ikke den eneste! Heldigvis eksisterer der et stort udvalg af forskellige antibiotika, der for det meste hurtigt kan udrydde de invaderende bakterier og gøre kroppen fri for infektion. Dog sker det oftere og oftere, at urinvejsinfektionen, som hovedsageligt skyldes bakterien E. coli, vender tilbage, når antibiotikabehandlingen stoppes.
Cirka 25% af tidligere smittede oplever, at infektionen blusser op igen indenfor seks måneder efter behandlingens ophør, og nogle særligt uheldige individer oplever op til seks tilbagefald i løbet af et år. Urinvejsinfektioner er derfor de hyppigst forekommende bakterieinfektioner verden over og påvirker op til 150 millioner mennesker hvert år.
Ud over at være skyld i personligt ubehag og sygdom, forårsager disse infektioner også alvorlige sundhedsmæssige og socioøkonomiske problemer, der kun bliver værre af, at de er så svære at komme af med. Der er mange spekulationer om, hvorfor så mange mennesker oplever disse problematiske tilbagevendende urinvejsinfektioner, og forskere i hele verden har prøvet at finde en forklaring på netop dette. Det er her, vi, en gruppe studerende på Roskilde Universitet, kommer ind i billedet.
Det har længe været kendt, at bakterier kan beskytte sig selv mod antibiotika og værtsorganismens immunsystem på mange forskellige måder. Et stigende antal bakteriearter overlever i dag intense antibiotikabehandlinger, og vi besluttede at dedikere vores bachelorprojekt til at belyse koncepterne og teorien bag de overlevelsesmekanismer, som bakterierne benytter sig af.
Bakteriernes overlevelsesmekanismer
Antibiotikaresistens beskriver bakteriers evne til at overleve og dele sig ved høje antibiotikakoncentrationer, uanset varigheden af behandlingen. I lang tid antog forskere, at resistens var hovedårsagen bag den stigende tendens til tilbagevendende urinvejsinfektioner. Dog er det blevet klart, at denne ikke kun skyldes bakteriernes evne til at udvikle antibiotikaresistens, men at to andre overlevelsesmekanismer kaldet tolerance og persistens også bidrager.
Når antibiotikummet raser, kan bakterier blive tolerante ved at nedsætte deres vækst markant. Nogle gange stopper de væksten helt og går i dvale, hvilket kaldes persistens. Da antibiotika primært rammer bakterier i vækst, kan overlevelsesmekanismerne tolerance og persistens gøre det muligt for hele bakteriepopulationen, eller en lille del af den, at overleve ved antibiotikakoncentrationer, der under normale omstændigheder ville slå dem ihjel. Efter behandlingens afslutning kan de tolerante eller persistente bakterier igen vokse og dele sig, som om intet var hændt. Og på den måde kan en urinvejsinfektion blusse op igen og igen.
Bakterien, Escherichia coli, eller bare E. coli, er den primære årsag til urinvejsinfektioner. E. coli lever normalt fredeligt i vores tarmsystem, hvor den blandt andet syntetiserer vitamin K, som optages og bruges i resten af vores krop. Dog er nogle typer af E. coli sygdomsfremkaldende, hvis de forlader tarmsystemet. E. coli er skyld i 75% af alle tilfælde af urinvejsinfektioner, som opstår, når bakterien migrerer fra endetarmen op gennem urinrøret og ind i blæren. Her invaderer bakterien blærecellerne og kan gå i dvale, hvilket delvist beskytter den mod antibiotikabehandling og kroppens eget immunforsvar.
Et problem ved, at der er flere forskellige bakterielle overlevelsesmekanismer i spil er, at de screening- og diagnosemetoder, der på nuværende tidspunkt benyttes, hverken er i stand til at detektere eller skelne mellem dem. Det er særligt problematisk i forhold til tolerante og persistente bakterieceller, som man fejlagtigt kan komme til at kategorisere som modtagelige over for et givent antibiotikum. Det er fordi bakterierne stopper deres vækst eller går i dvale og derfor ikke ser “levende” ud, som resistente bakterier gør, når de dyrkes med antibiotika. Med andre ord ser det ud som om, at de tolerante eller persistente bakterier dør ved lige så lave antibiotikakoncentrationer som de modtagelige.
I virkeligheden dør bakterierne ikke, men gemmer sig for antibiotika ved at nedsætte deres cellulære processer og derved stoppe deres vækst eller helt gå i dvale. Konklusionen fra laboratoriet vil derfor være, at patientens infektion kan behandles med det afprøvede antibiotikum. Og så har vi balladen, når bakterierne overlever antibiotikakuren og på ny kan inficere urinvejene, når behandlingen er slut.
Kunsten at skelne mellem mekanismerne
På baggrund af den ovenstående viden, har vi i vores bachelorprojekt sammenfattet en ny procedure, som gør det muligt at skelne mellem resistens, tolerance og persistens. Denne foreslåede procedure gør det også muligt at finde frem til, hvorfor infektionen ikke forsvinder efter behandling.
Tolerancetest
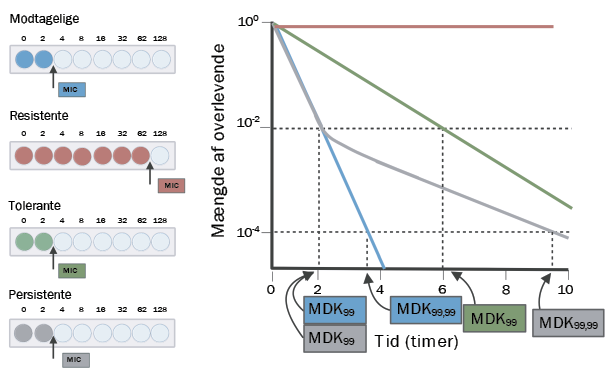
Til venstre ses det teoretiske resultat fra en MIC-test, som bruges til at bestemme, hvor meget antibiotika, der skal til for at slå en bakteriepopulation ned (MIC = Minimum Inhibitory Concentration). Som det ses på billedet, skal der markant højere antibiotikakoncentrationer til at hæmme resistente bakterier end modtagelige, tolerante og persistente bakterier.
Til højre vises en teoretisk kurve for overlevelsen af bakterier over tid ved en antibiotika-behandling (på figuren står MDK for Minimum Duration for Killing). Her ses det for de modtagelige bakterier (blå linje), at 99% af populationen er udryddet efter to timer og 99,99% efter fire. For de persistente bakterier (grå linje) tager det også to timer at udrydde 99% af populationen, men hele 10 timer at udrydde 99,99%, da en lille subpopulation er persistente. For de tolerante bakterier (grøn linje) tager det markant længere tid at slå 99% af populationen ihjel sammenlignet med en modtagelig population. Den røde linje illustrerer de resistente bakterier, hvor mængden af overlevende forbliver konstant, da populationen ikke påvirkes af antibiotikakuren.
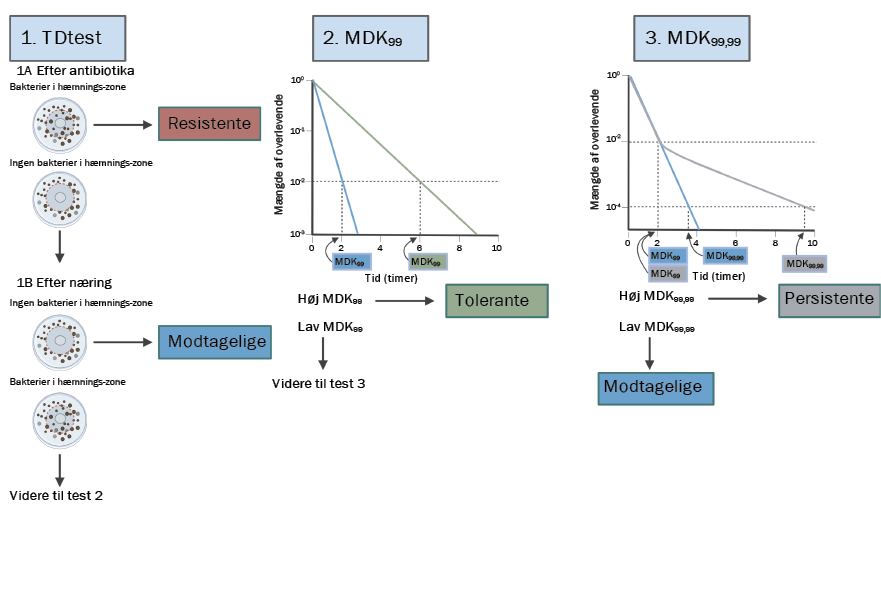
Proceduren (se flowdiagram) består af flere skridt for at sikre, at man kan opdage og derved behandle tolerante eller persistente bakterier korrekt. Det første skridt i proceduren er en såkaldt Tolerance Disk test (TDtest), oprindeligt udviklet af den israelske forsker Orit Gefen og kolleger i 2017. Denne test er en videreudvikling af den oprindelige disk diffusion test, hvor man dyrker bakterier i en petriskål med næring og derefter udsætter dem for antibiotika. Hvis bakterierne ikke dør af antibiotikummet, er de resistente, men hvis det derimod ser ud som om, de dør, kan dette indikere, at de er modtagelige.
Det særlige ved TDtesten er, at der tilføjes næring efter antibiotikabehandlingen, for at se om de tilsyneladende modtagelige og formodet dræbte, bakterier vokser frem på ny. Hvis dette er tilfældet, indikerer det, at der er tolerante eller persistente bakterier til stede. Det er dog vigtigt, at man vælger et medium, der efterligner det naturlige miljø i urinvejene, når man laver TDtesten, da dette har en effekt på, hvor modtagelige bakterierne er over for antibiotika, og derfor kan påvirke resultatet af testen
TDtest
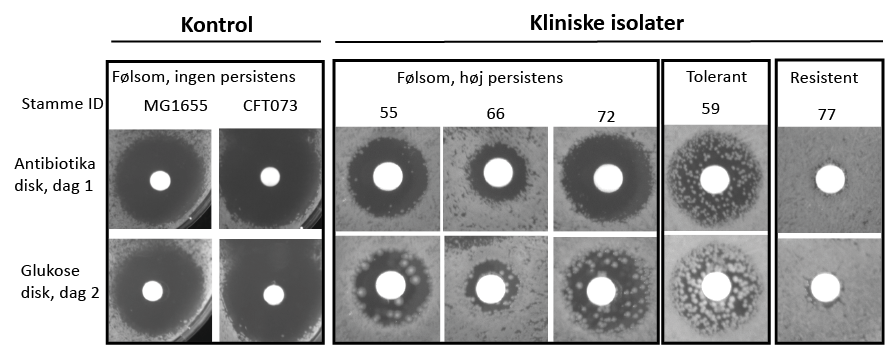
Billederne viser forsøg med forskellige kliniske isolater af E. coli fra Hvidovre Hospital, der repræsenterer både modtagelige, persistente, tolerante og resistente bakteriestammer. Forsøgene illustrerer den såkaldte TDtest.
Bakterierne dyrkes på agarplader, hvor de udsættes for antibiotika, der er tilføjet til den hvide disk i midten. Herefter inkuberes bakterierne ved 37°C. Hvis bakterierne hæmmes af antibiotikummet, vil en mørk zone uden vækst vise sig omkring den hvide disk i løbet af dag 1.
Hvis der ses en hæmningszone, betyder det, at bakterierne er modtagelige over for antibiotikummet, hvorimod en manglende hæmningszone indikerer resistens.
På dag 2 udskiftes antibiotika-disken med en glukose-disk. Ved tilføjelse af næring, i form af glukose, kan man efter en dag se, at bakterier som har overlevet antibiotikabehandlingen, uden at være resistente, er vokset frem i hæmningszonen. Disse overlevende bakterier er enten tolerante eller persistente.
Hvis TDtesten indikerer, at der er tolerante eller persistente bakterier til stede, er andet skridt i proceduren at lave en time-kill curve, hvorfra man kan bestemme, hvor lang tid det tager at udrydde 99% og 99,99% af bakterierne. Ud fra dette kan man konkludere, om populationen er henholdsvis tolerant eller persistent. Hvis alle bakterierne dør med samme hastighed over tid, er der tale om en tolerant population, men hvis en lille del af populationen (cirka 1%) overlever længere end de andre, er der tale om en persistent population, som enten kan være dosis- eller varighedsafhængig.
Optimering af behandlingen
Vi mener, at det på baggrund af den foreslåede procedure vil være muligt at optimere behandlingen af tilbagevendende urinvejsinfektioner. I de tilfælde, hvor man har med en resistent eller dosisafhængig, persistent bakteriepopulation at gøre, foreslår vi, at man enten øger bakteriepopulationens modtagelighed med et supplement, eksempelvis aminosyren cystein, som blandt andet tranebær har et højt indhold af, eller forhøjer dosen af antibiotika. Hvis populationen derimod er tolerant eller varighedsafhængig persistent, kan en øget varighed af behandlingen være en løsning. Derudover kan et antibiotikum, der er målrettet bakterier med nedsat vækst, være at foretrække, da både tolerante og persistente bakterier ofte har netop det.
Fordelen ved at bruge en metode, der kan skelne mellem bakterier, der er modtagelige overfor antibiotika fra dem, som har udviklet resistens, tolerance eller persistens er altså, at det giver bedre mulighed for at lave en individuel behandling, som effektivt slår infektionen ned. Det kan forhåbentlig medvirke til, at vi i fremtiden kan sætte en endelig stopper for de frustrerende tilbagevendende urinvejsinfektioner. Udfordringen er, at det vil tage lidt længere tid at nå frem til den rette behandling, men det må klart være at foretrække over gentagne smertefulde urinvejsinfektioner. ♦