Titan: En mulig kemisk superstjerne
Dansk forsker forsøger at udvikle katalysatorer af titan. Det vil gøre kemisk produktion af en lang række stoffer billigere, end det er muligt i dag.
Inden for industriel produktion af alle tænkelige kemikalier går én ting igen og igen, og det er brugen af en katalysator.
Katalysatorer er kort sagt forbindelser, der får kemiske processer til at ske hurtigere og billigere, hvilket alt andet lige er to attraktive egenskaber, når man lever af at lave kemi.
Når to kemikalier skal reagere med hinanden og danne et tredje, har de brug for en aktiveringsenergi til at sætte den kemiske proces i gang. Denne energi kan komme fra alt fra kul og naturgas til elektricitet og er ofte et fordyrende trin i industriel produktion af kemikalier. Katalysatorer sænker reaktionsbarrieren og dermed behovet for aktiveringsenergi i en kemisk proces og får på den måde processen til at forløbe hurtigere og billigere.
Traditionelt bliver katalysatorer ofte lavet af dyre ædelmetaller som ruthenium, rhodium, platin eller palladium, som er dyre, fordi de er sjældne og kun findes i meget små mængder i jordskorpen. Det vil en dansk forsker dog lave om på ved i stedet at lave katalysatorer af titan, hvilket der er mere end rigeligt af overalt i jorden.
Titan er det næstmest forekommende overgangsmetal i jordskorpen. 0,6 procent af jordskorpen består af titan, og kun jern overgår, med sine 5,6 procent, titan i at være det overgangsmetal, der er mest af. Fordi der er så meget titan i jorden, vil det være et billigt grundstof at lave katalysatorer af, og hvis man samtidig kan fremstille effektive katalysatorer af titan, vil der også være penge at spare på energiforbruget til at drive industrielle kemiske processer.
»Allerede før man begyndte at tænke i klimaforandringer, var kemikere interesserede i at have gode katalysatorer, fordi det koster mange penge at varme kemiske reaktorer op til temperaturer, hvor de kemiske processer kan ske af sig selv. Men katalysatorer af ædelmetaller er desværre dyre, og derfor kan der være en masse penge at spare, hvis man kan udvikle gode katalysatorer af overgangsmetaller, som der er rigeligt af,« fortæller adjunkt Anders Reinholdt fra Lund Universitet.
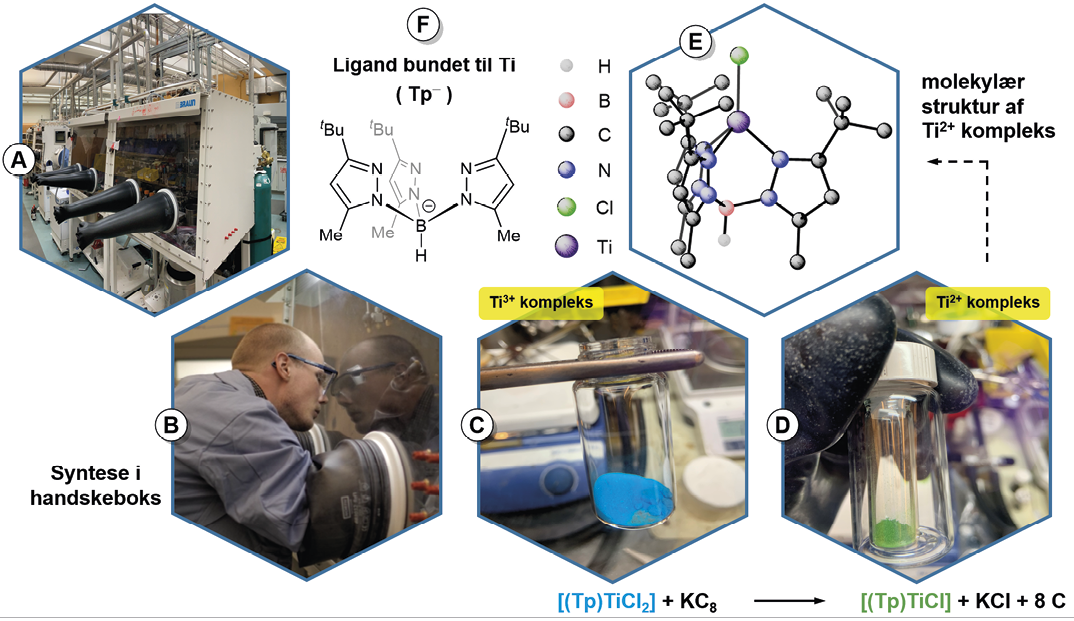
Figur 1. Syntese af et tetraedrisk Ti2+-kompleks. A) For at undgå nedbrydningsreaktioner med H2O og O2 håndteres alle forbindelser af titan i en handskeboks fyldt med ultrarent argon. B) Reaktionsopstillinger opsættes ved hjælp af de indbyggede handsker. C) Det blå Ti3+-kompleks. D) Det grønne Ti2+-kompleks, som dannes ved reduktion med kaliumgrafi t (KC8). E) Tegning af Ti2+-komplekset; for at gøre tegningen mere overskuelig er H-atomer udeladt (på nær det, som er bundet til B-atomet). F) Stregtegning af liganden, som indkapsler titan.
Titan skal gøres reaktiv
Nuvel, det er let at have våde drømme om titan som centrum i katalysatorer til alverdens kemi. Den svære del er at udvikle disse katalysatorer.
Udfordringen for titan er, at dette overgangsmetal kun naturligt optræder i sit højeste oxidations-trin, hvor alle atomets elektroner i den yderste elektronskal er væk. Forskere kalder det for Ti4+, når titan mangler fire negativt ladede elektroner, og så er det ikke særligt godt at lave god kemi med. Ti4+ er den form, som titan indgår med i for eksempel mineraler og bjergarter, men det kan ikke bruges til meget, da gode katalysatorer skal have et variabelt antal elektroner i deres yderste atomskaller, så de er i stand til at overføre elektroner til og fra de stoffer, hvis kemiske reaktioner der skal katalyseres.
Anders Reinholdt fortæller, at hele ideen med at bruge overgangsmetaller som katalysatorer er, at de med et variabelt antal elektroner kan gøre andre molekyler mere reaktive. Titan med én elektron i sin yderste elektronskal som Ti3+ eller endnu bedre med to elektroner som Ti2+ vil give noget spillerum for at agere katalysator for kemiske processer.
»Man kan jo ikke bare hælde en sten ned i en spand med kemikalier og forvente, at den vil være en god katalysator. Man skal skabe betingelserne for, at det vil fungere godt,« siger han.
Titan reagerer ekstremt kraftigt med luft
Selvom endemålet med Anders Reinholdts forskning er at udvikle katalysatorer af titan, er de første skridt på vejen dertil blot at blive klogere på titan som kemisk komponent.
I laboratoriet forsker Anders Reinholdt i, hvad der sker med titan, når han ændrer ved antallet af elektroner i atomets yderste elektronskal, altså ændrer oxidationstallet. Formålet med Anders Reinholdts forskning er at opbygge et molekyle med gode katalytiske egenskaber, hvor titanatomet kan jonglere elektroner mellem andre molekyler og på denne måde muliggøre svære kemiske reaktioner.
Indledningsvist i forskningen har Anders Reinholdt pakket titan ind i såkaldte ligander, der er kemiske grupper, som danner en veldefineret geometrisk struktur rundt om titan-atomet. Når man kan styre geometrien rundt om titan, kan man også styre, hvordan det som katalysator skal reagere med andre molekyler.
Anders Reinholdt fortæller, at det på den måde er muligt i laboratoriet at lave Ti3+, hvis man er meget omhyggelig og har de rigtige værktøjer til rådighed. Da forskeren i sine forsøg lavede Ti3+ indkapslet i en ligand, skabte han et stof med en dybblå farve, som i opløsninger ligner vinduesrens. Med hjælp af kaliumgrafit, der er en meget reaktiv forbindelse, som meget villigt overfører elektroner til andre molekyler, tvang han endnu en elektron ind i titans yderste skal og fik dermed skabt Ti2+, som er grønt og ekstremt reaktivt.
»Det hele skal laves i en handskeboks, der er en tætforseglet kasse fyldt med ultrarent argon – en ædelgas, der ikke kan reagere med noget som helst. Alt, hvad man laver i kassen, skal gøres ved hjælp af to handsker, som man stikker ind i kassen. Grunden til det er, at Ti2+ er voldsomt reaktivt og vil reagere kraftigt med luftens oxygen eller sågar nitrogen, hvis det kommer i kontakt med det,« forklarer Anders Reinholdt.
Katalysatorer
En katalysator er kort sagt en forbindelse, der øger hastigheden af en kemisk reaktion uden selv at blive omdannet eller forbrugt undervejs. Formålet med at tilsætte en katalysator til en reaktionsblanding er at få reaktionen til at forløbe via alternative reaktionsveje og med lavere behov for aktiveringsenergi, da katalysatoren sænker reaktionsbarrieren i den kemiske proces.
Inden for katalysatorer skelner man mellem homogen katalyse og heterogen katalyse. Ved homogen katalyse befinder katalysatoren sig på samme form (i samme fase) som de reaktanter, der skal indgå i den kemiske reaktion. Det kan for eksempel være, at både reaktanter og katalysator er på væskeform.
Ved heterogen katalyse optræder katalysatoren på en anden form end reaktanterne. Det kan være, at et fast stof benyttes til at katalysere en kemisk proces mellem to væsker eller to gasser.
I en af de mest kendte katalytiske processer spiller jern en central rolle i omdannelsen af nitrogen og hydrogen til ammoniak. Processen er kendt som Haber-Bosch-processen og kastede i både 1918 og 1931 en Nobelpris i kemi af sig. 454 millioner ton gødning bliver hvert år produceret ved hjælp af Haber-Bosch-processen.
Den danske virksomhed Topsøe A/S udvikler og sælger katalysatorer til fremstilling af en lang række kemikalier. Det estimerede marked for katalysatorer er på over svimlende 200 mia. kr. om året, og behovet for katalysatorer bliver kun større i fremtiden.
Reaktionskinetik
Reaktionskinetik er den del af kemien, som beskæftiger sig med, hvordan en kemisk reaktion forløber, hvor hurtigt den forløber, og hvilke delreaktioner den består af. De delreaktioner, som har betydning for forståelsen af den samlede kemiske reaktion, kaldes for elementarreaktioner. Elementarreaktionerne er reaktioner, hvor et, to eller flere molekyler kolliderer og danner et produkt gennem en kemisk reaktion.
Kemikere benytter forskellige metoder til at kortlægge elementarreaktionerne i en kemisk proces. Heri er et centralt element at forstå, hvor hurtigt elementarreaktionerne forløber, hvilket er afhængigt af blandt andet temperatur.
I Anders Reinholdts forsøg har han benyttet informationer om koncentrationen af reagenserne som funktion af tid til at bestemme reaktionshastigheden i omdannelsen af azid til et azid-kompleks eller et imid-kompleks. Til det formål benyttede forskeren NMR-spektroskopi, som danner et spektrum over det magnetiske felt omkring atomer. Det vil sige, at spektret for et azid-kompleks ser anderledes ud end spektret for et imid-kompleks.
Ved først at udføre NMR-spektroskopi på rene prøver af imid-komplekset og derefter rene prøver af azid-komplekset kunne forskeren efterfølgende undersøge spektre af reaktionsblandingen til forskellige tidspunkter og dermed kortlægge, hvor høj koncentrationen af de forskellige komplekser var til givne tidspunkter (figur 3).
Disse koncentrationer af de forskellige komplekser benyttede han til at bestemme reaktionernes hastigheder.
Lavede som den første bestemt kemisk struktur
Anders Reinholdt er ikke den første forsker i verden til at interessere sig for titans kemi, men han er med til at pionere forskningen.
Ti3+ har været kendt i mere end 100 år, hvor forskere har undersøgt titan i dette lavere oxidationstrin. De første succesfulde forsøg på at lave Ti2+ skete i 1980erne, men der er forskel på de ligander, som overgangsmetallet bliver pakket ind i. Heri ligger også en interessant detalje.
Traditionelt har forskere kun været i stand til at pakke Ti2+ ind i såkaldte oktaedriske geometrier, hvilke vil sige, at titan er omgivet af ligander, der tilsammen er bundet seks steder til overgangsmetallet. Anders Reinholdt er som den første forsker lykkedes med at pakke sit ekstremt reaktive titan ind i ligander, der kun er bundet fire steder til overgangsmetallet og dermed skabt en tetraedisk geometri omkring atomet.
Det lyder måske som en detalje for keminørder, men det er faktisk enormt betydningsfuldt. Når et titan-atom er omgivet af seks ligander, er det for indkapslet, til at andre molekyler kan komme ind til atomet og reagere med det. Så virker det heller ikke særligt godt som katalysator. Men med kun fire ligander bliver tilgængeligheden til titan øget, og det åbner op for det katalysatorpotentiale, som hele Anders Reinholdts forskning sigter mod at realisere.
»Den tetraedriske ligandstruktur omkring titan fandtes ikke før 2020, hvor vi fremstillede det for første gang. Det var ret fedt, da det lykkedes, fordi man i mange år havde diskuteret, om det overhovedet kunne lade sig gøre, eller om systemet simpelthen ville være for reaktivt. Men det kunne lade sig gøre, og den tetraedriske ligandstruktur kan sammenlignes med, at man indkapsler et reaktivt monster i et bur, som man kan lukke det ud af, når det skal rive og flå i andre molekyler i forbindelse med katalysering af en kemisk proces,« forklarer han.
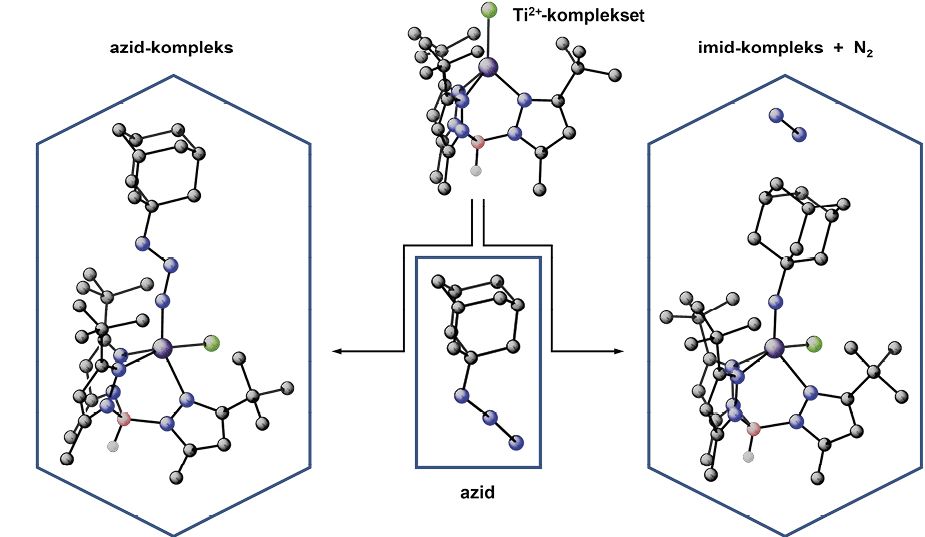
Figur 2. Når Ti2+-komplekset reagerer med et organisk azidmolekyle, giver reaktionen ganske forskellige produkter, afhængig af hvordan reaktanterne tilsættes. Til venstre ses dannelsen af et azid-kompleks, hvor azidet binder til Ti2+ uden at få brudt nogen af sine bindinger. Til højre ses dannelsen af et imid-kompleks, hvor azidets ene N-N binding bliver brudt, samtidig med at et N2-molekyle bliver dannet.
Titan opfører sig som en tryllekunstner
Efter udviklingen af den tetraedriske ligandstruktur omkring titan var det blevet tid til at lave grundforskningseksperimenter med komplekset for at karakterisere dets reaktionsmønstre og de egenskaber, som Ti2+ har i komplekset.
Klassiske Ti2+-komplekser med en oktaedrisk ligandstruktur reagerer meget hurtigt med såkaldte azider, der er forbindelser med en kemisk formel, hvori der indgår tre nitrogenatomer. I hverdagen kendes azid-salte blandt andet fra airbags, hvor azidet kan gå i stykker og afstøde N2 (den form for nitrogen, der udgør 78 pct. af atmosfæren), hvorved airbaggen pustes op.
Indtil videre har forskere dog ikke kendt meget mere til den kemiske reaktion mellem Ti2+ og azid, end at der sker en afstødning af N2, og at der ud over det bliver dannet et produkt med en tripelbinding (figur 2). Dette produkt hedder inden for kemien et imid-kompleks. Et imid er en kemisk gruppe, der anvendes i blandt andet organisk syntesekemi og indgår i biologisk aktive molekyler som for eksempel lægemidler og pesticider.
»Imider kan man overføre til en lang række mindre kemiske molekyler og klistre dem sammen som legoklodser. Det har Ti2+ vist sig at være godt til. Først danner Ti2+ et imid-kompleks og overfører derefter imid-gruppen til et andet molekyle, hvorefter Ti2+ kan virke som en katalysator igen. Men man har ikke før nu vidst meget om, hvordan de her kemiske reaktioner forløber. Det er som en tryllekunst, hvor man ikke kan nå at følge med i, hvad tryllekunstneren laver med sine hænder. Man kan bare se, at de førhen var tomme, men at der nu er en kanin i en af dem. Sådan er det også med denne kemiske reaktion. Vi kender ganske vist til startpunktet og slutpunktet, men vi vil gerne vide, hvad der sker ind imellem,« forklarer Anders Reinholdt.

For at undgå nedbrydningsreaktioner med H2O og O2 håndteres alle forbindelser af titan i en såkaldt handskeboks fyldt med ultrarent argon.
Forsøg gav ingen mening
Anders Reinholdt ønskede at finde ud af mere om den kemiske reaktion mellem Ti2+ og azider i dannelsen af imider og lavede derfor en lang række studier af reaktionsforløbet. En af disse undersøgelser viste som noget af det første, at der ved reaktionen ikke bare bliver dannet et imid-kompleks med dertilhørende afstødning af N2. Ydermere bliver der dannet et azid-kompleks med azid bundet til Ti2+, uden at der ryger et N2 i svinget.
Forskeren kløede sig først i hovedbunden og gav sig derefter til at undersøge, om noget ved selve reaktionsbetingelserne påvirkede udbytteforholdet mellem imid- og azid-komplekset. Her startede han med nogle meget simple forsøg, hvor han dryppede én ækvivalent af azid ned i Ti2+-komplekset og observerede, hvad udfaldet blev. Denne tilgang resulterede i, at forholdet mellem de to produkter blev omtrent 1:1, altså et udbytte på ét imid-kompleks pr. ét azid-kompleks.
Da forskeren efterfølgende byttede rundt på rækkefølgen og dryppede Ti2+ ned i azid, blev der næsten udelukkende dannet azid-komplekset og ikke meget imid. På samme måde blev der næsten udelukkende dannet azid-komplekset, da forskeren blandede azid i Ti2+ i forholdet 10:1. Omvendt blev der slet ikke dannet noget azid-kompleks, da forskeren blandende de to komponenter med mere Ti2+ end azid. Så blev der kun dannet imid.
Resultaterne af de mange forsøg var en gåde, men de pegede i den interessante retning, at der skulle anvendes et overskud af Ti2+ sammenlignet med mængden af azid, for at komplekset kunne afstøde N2 i den kemiske reaktion.
»Det er altid interessant, når A + B ikke giver det samme resultat som B + A. Det er faktisk sjældent, at det sker. Når man uddanner kemikere, fortæller man dem, at det næsten er ligegyldigt, om man hælder det ene i det andet eller omvendt, men lige i dette tilfælde er det altså ikke ligegyldigt,« siger Anders Reinholdt.
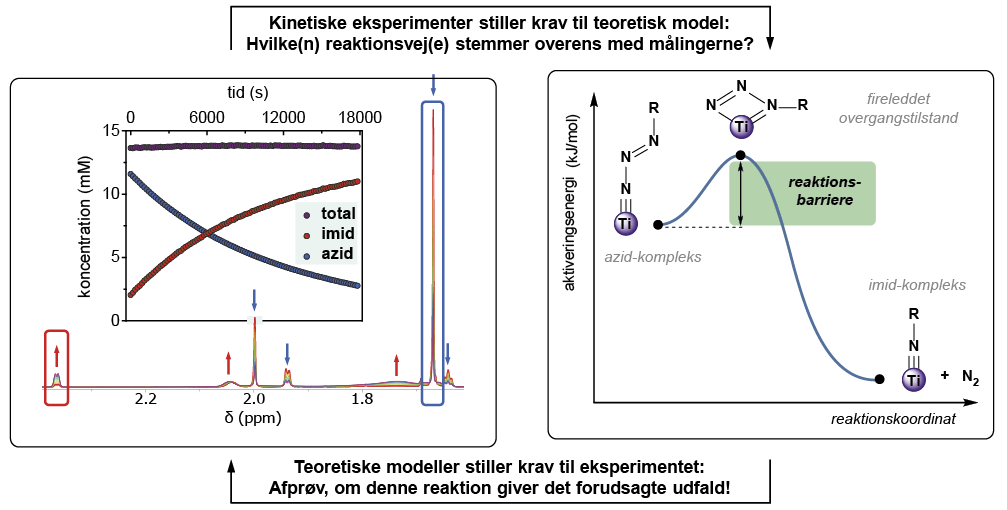
Figur 3. Den kombinerede anvendelse af kinetiske eksperimenter og teoretisk modellering giver en dybere forståelse af omdannelsen af azid-komplekset til imid-komplekset. Til venstre ses, hvordan NMR-spektret af en reaktionsblanding ændrer sig over tid ved 70 °C. Toppe fra azid-komplekset bliver mindre intense (blå pile), mens toppe fra imid-komplekset bliver mere intense (røde pile). Den indsatte figur viser toppenes areal omregnet til koncentrationer, som sidenhen giver indblik i reaktionsordenen og aktiveringsenergien. Til højre ses et teoretisk udregnet reaktionsforløb, hvor azid-komplekset danner en fire-leddet overgangstilstand, inden N2 afstødes og imid-komplekset dannes. Reaktionsbarrieren kan aflæses fra kurven for aktiveringsenergi.
Identificerede den korrekte kemiske reaktion
Det næste skridt i forskningen var at komme endnu et lag dybere ned i forståelsen af den kemiske reaktion. Til det formål benyttede Anders Reinholdt reaktionskinetik, som kan gøre forskere klogere på blandt andet reaktionshastigheder, og hvor meget energi der skal til, for at en given reaktion kan forløbe.
Anders Reinholdt fokuserede først og fremmest på azid-komplekset. Her fandt han ud af, at når han opvarmede komplekset til over 50 grader celsius, afstødte det N2 og blev omdannet til imid-komplekset. Imid-komplekset var også det molekyle, som han hele tiden havde regnet med at få ud af processen.
Efterfølgende udregnede han, at der skulle en mængde energi svarende til 110 kJ/mol for at få azid-komplekset til at afstøde N2 og blive til imid-komplekset. 110 kJ/mol er også det, som vi tidligere i denne artikel omtalte som aktiveringsenergien, altså hvor meget energi der skal til at få en reaktion til at forløbe. Omregnet til det, som forskere kalder for halveringstid, svarer det til, at halvdelen af alle azid-komplekserne vil blive omdannet til imid-komplekser i løbet af to måneder, hvis de bare få lov til at stå i en skål ved stuetemperatur.
Taler vi om katalysering af industrielt interessante kemiske processer, er to måneder nok lige i overkanten af, hvad man har tålmodighed til.
Da Anders Reinholdt havde fundet størrelsen på aktiveringsenergien, gik han sammen med en sydkoreansk forskergruppe, der er specialiseret i teoretisk kemi og med computerprogrammer kan udregne alle mulige måder, hvorpå to molekyler kan indgå i en reaktion. Samtidig kan de sydkoreanske forskere se, hvad det vil koste i energi at få reaktionen til at forløbe, og ved at sammenligne med aktiveringsenergien fra kinetikeksperimenter kan man finde ud af, hvilket af de teoretiske reaktionsforløb der faktisk er det, som sker i den virkelige verden.
»De sydkoreanske forskere kom tilbage med flere forskellige mulige reaktioner, men kun én af dem kostede 110 kJ/mol. Så vidste vi, hvilken reaktion der var den rigtige. Der sker det, at azid-gruppen bøjer rundt, og azidet binder sig fast to steder på titan-atomet. Det danner derved en fire-leddet ring, som gør det muligt for N2 at slippe fri, så imid-gruppen kan binde til titan-atomet i stedet for. Blandt de alternative teoretiske reaktionsveje fandt de sydkoreanske forskere et forløb, hvor azidet i stedet dannede en tre-leddet ring med titan, men den krævede over 170 kJ/mol,« forklarer Anders Reinholdt.
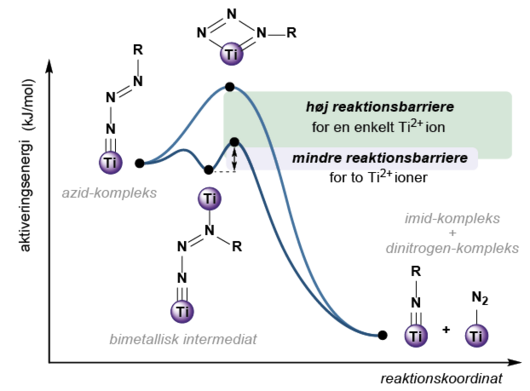
Figur 4. Sammenligning af to parallelt forløbende reaktionsforløb: Enten bryder et enkelt titan-atom N-N-bindingen i azidet på egen hånd (høj reaktionsbarriere), eller også bryder to titan-atomer N-N-bindingen i azidet ved at samarbejde (mindre reaktionsbarriere). Sameksistensen af en høj og en lav reaktionsbarriere forklarer, at reaktionen i figur 2 både kan føre til et azid-kompleks og et imid-kompleks afhængig af, hvordan reaktanterne sammenblandes.
Titan-atomer arbejder sammen i par
Anders Reinholdt forklarer, at de mange eksperimenter ledte frem til opdagelsen af en reaktionsvej for omdannelsen af azid til imid, som det kræver mere end ét Ti2+ at håndtere. Når der er et underskud af Ti2+ til at drive processen, tager det to måneder for den at forløbe, men er der til gengæld et overskud af Ti2+, tager det 10 millisekunder.
De sydkoreanske forskere fortsatte deres analyse af den kemiske reaktion, og her kunne de vise, at når der er to Ti2+ til stede i reaktionsblandingen for hver azid, samarbejder de to Ti2+ om at sænke reaktionsbarrieren, så den kommer helt ned på 42 kJ/mol. Reaktionen vil derved forløbe meget hurtigere, fordi der skal mindre energi til at drive den. Fundet gav i den grad mening, fordi det bekræftede det, som Anders Reinholdt havde set i laboratoriet, nemlig at når der var nok Ti2+ til stede, gik reaktionen meget hurtigt, mens den gik meget langsomt, når det ikke var tilfældet.
»Det har været et skoleeksempel på, hvordan eksperimentel kemi og teoretisk kemi kan arbejde sammen om at løse mysterier; i det her tilfælde hvordan et enkelt metal kan have en høj reaktionsbarriere for at klippe et azid i stykker, men at to kan arbejde sammen om at gøre det meget hurtigere og med et mindre energikrav. Det var den interessante konklusion, og den form for forgrenede reaktionsveje ser man sjældent, når man undersøger reaktionshastigheder,« siger Anders Reinholdt. ♦