Cellernes vitale svingninger
De seneste år er det blevet påvist, at koncentrationen af en række afgørende proteiner i cellekernen udviser veldefinerede svingninger. Ny forskning forklarer, hvordan disse svingninger er med til at optimere vitale processer som DNA-reparation.
Af Mathias Spliid Heltberg.
Siden de tidligste videnskabspersoner så op mod nattehimlen og begyndte at deducere, hvordan himmellegemerne bevæger sig, har oscillationer – eller svingninger – været et koncept, man nødvendigvis har måttet benytte. Oscillationer er en betegnelse for noget periodisk – altså noget, der vender tilbage igen som solens bevægelse over himlen (grundet jordens rotation) eller årstidernes variation.
I fysikken har man gennem tiden fundet utallige eksempler på oscillerende systemer, hvilket betyder at de opfylder den matematiske definition på et sådant system (se boks). Det kan være alt fra atomers vibrationer til koncentrationen af proteiner i vores organisme, hvor det sidste netop er det, jeg vil fortælle om i denne artikel.
Proteinkoncentrationer med rytme
I kroppens celler findes der tusinder af forskellige proteiner, som varetager alle vitale funktioner i cellerne. Derfor er det afgørende, at cellerne kan kontrollere produktionen af proteiner. Dette styres i høj grad af såkaldte transkriptionsfaktorer, som er proteiner, der på genniveau regulerer produktionen af hundredevis af andre proteiner.
I de seneste årtier er der opstået en stor interesse for, hvordan koncentrationen af transkriptionsfaktorer varierer over tid. Et klassisk eksempel på dette er en transkriptionsfaktor kaldet NF-kB. Denne er påvist at regulere aktiviteten af flere hundrede forskellige gener og have en afgørende betydning for immunforsvarets funktion, og mutationer i dette protein er korreleret med udbrud af sygdomme som diabetes og cancer. Når en celle stimuleres udefra med proteiner, som forøges i koncentration, når immunsystemet arbejder, begynder koncentrationen af NF-kB inde i cellekernen at svinge med en periode på cirka halvanden time.
Et andet eksempel er proteinet p53, der ligeledes regulerer hundredevis af gener, og mutationer i dette protein er koblet til omtrent 50 % af alle cancertilfælde. Det skyldes, at p53 spiller en afgørende rolle i reguleringen af celledelinger og sikrer, at cellen ikke deler sig, når der er skade på DNA’et. For p53 blev det ligeledes i starten af dette århundrede påvist, at når en celle får mange skader på sit DNA, igangsættes svingninger i proteinets koncentration i cellekernen, her med en periode på cirka 5 timer (hvilket jeg kommer tilbage til senere i artiklen).
Opdagelsen af de oscillerende proteinkoncentrationer, der tydeligvis har en periode, har åbnet for det helt fundamentale spørgsmål: Hvad er funktionen af sådanne svingninger?
Oscillationer matematisk set
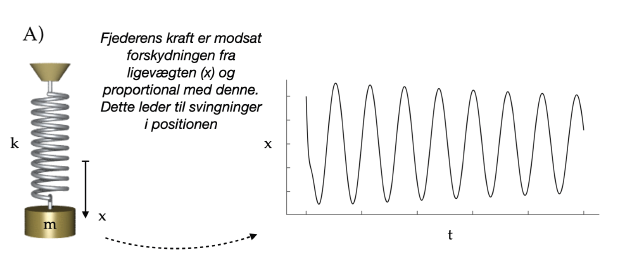
Matematisk defineres en oscillerende funktion helt simpelt:
x(t) = x(t + T)
Hvor T er svingningens periode, og altså den tid det tager, før systemet vender tilbage til sin oprindelige position.
Et stort skridt fremad i studiet af svingninger blev taget af den britiske fysiker Robert Hooke, der opdagede, at en fjeder har en kraft, der er proportionel med afstanden til ligevægtspositionen. Han formulerede dette som:
ut tensio, sic vis (“som forlængelsen, således kraften”). Ved at benytte den af Isaac Newton netop udviklede differentialregning, kunne man vise at et hvert system, der opfylder denne regel vil bevæge sig som en svingning:
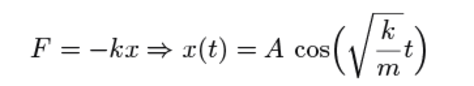
Signaler i svingning og kaos
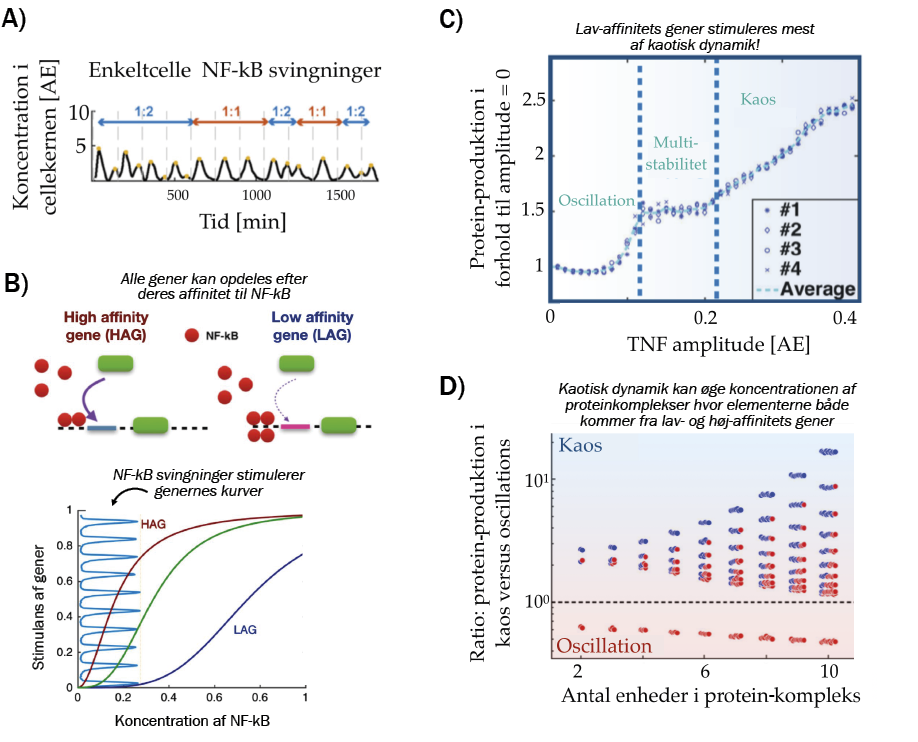
Først og fremmest er det nærliggende at overveje, hvorledes oscillationer kan regulere specifikke gener. Vi har i vores forskning studeret dynamikken af koncentrationen af NF-kB, der som tidligere nævnt kan sættes i svingninger og endda svinge med to forskellige periodelængder, hvis det stimuleres udefra. Som en grundlæggende model, har vi opdelt alle gener, der stimuleres af NF-kB-proteinet efter deres affinitet, det vil sige hvor let de kan stimuleres af NF-kB. Her har vi kunnet vise, at vi kan stimulere henholdsvis lav- og højaffinitets-gener ved at ændre på, hvordan koncentrationen af NF-kB svinger. Således kan man med store amplituder stimulere gener med lav affinitet, mens man med en mere konstant gennemsnitsværdi (og dermed mindre svingninger) kan stimulere gener med høj affinitet. Det åbner for en helt ny måde at betragte gen-regulering, idet man med oscillerende dynamik kan op- og nedregulere hele familier af gener med den samme transkriptionsfaktor, der udelukkende virker stimulerende på de forskellige gener.
Vi har endvidere studeret andre typer af dynamik, og specielt har vi opdaget, hvorledes kaotisk dynamik kan benyttes som regulerende element blandt celler. Kaotisk dynamik er kort fortalt beslægtet med svingninger, men et kaotisk dynamisk system vil aldrig gentage sin bevægelse og dermed ikke have den periodiske bevægelse, vi finder i svingninger, men dog stadig udvise udsving af varierende størrelse. Det har længe været en hypotese i biologi, at kaotisk dynamik var noget, levende organismer skulle undgå, idet det leder til uorden og mangel på kontrol. Men nyere teoretiske resultater har åbnet for muligheden for, at kaotisk dynamik kan lede til en yderlig opregulering af gener med lav affinitet.
De varierende udsving fra kaotisk dynamik giver også anledning til en forøgelse i effektiviteten, hvormed proteinkomplekser dannes. Ved at studere en simpel model for, hvordan proteiner sammensættes, kan man finde, at disse samles på en mere effektiv måde ved kaotisk dynamik.
Det muliggør altså en vigtig rolle for variationen i koncentrationen af transkriptionsfaktorer over tid, og hvordan det kan lede til forøget proteinsyntese i visse situationer. Det er noget, vi gennem eksperimenter vil studere nærmere i den kommende tid i samarbejde med kolleger fra USA, Kina og Taiwan.
Figur 2. A) Svingninger i NF-kB under oscillerende stimulus fra TNF [2].
B) Skematisk model af, hvordan gener stimuleres af oscillationer af stor amplitude.
C) Gennemsnitsproduktionen af lav-affinitets proteiner som funktion af TNF amplituden [3].
D) Produktionen af proteinkomplekser. x-aksen viser kompleksets størrelse, y-aksen viser forholdet mellem produktionen i kaotisk NF-kB dynamik og oscillerende NF-kB dynamik, mens punkterne angiver sammensætningen af proteinkomplekser (blå= lav affinitet, rød = høj affinitet).
DNA-reparation og faseovergange
I levende organismer bærer DNA-molekylet information om alle de proteiner, der både indgår i strukturer og som katalyserer cellens mange processer. Særligt for flercellede organismer er det helt afgørende, at DNA forbliver intakt.
Det er dog et livsvilkår, at der kan opstå skader på DNA på alle niveauer og livsstadier, og derfor er det vigtigt for organismen at have en effektiv og optimeret respons på disse mutationer.
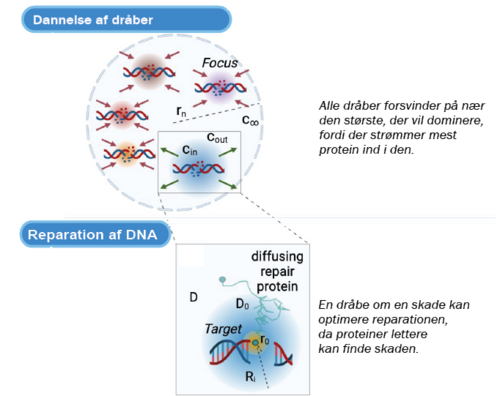
I de seneste år har man kunnet påvise, at der omkring det skadede DNA-område dannes en mikro-struktur med radius på cirka 100 nm, kaldet et fokus. Dette fokus har vist sig at være en egentlig dråbe, og den opstår på samme måde, som hvis man tilfører en smule olie til et glas med vand, hvor olie-molekylerne vil mindske deres frie energi ved at samles i en dråbe. Indenfor fysikken siger vi, at der er sket en faseovergang. Det har vist sig, at et sådant lokalt miljø omkring det skadede DNA giver cellen mulighed for at opregulere de proteiner, der er nødvendige for reparationsprocessen og dermed øge effektiviteten og kvaliteten. Det er en ekstremt effektiv måde at optimere reparationen af DNA, idet de nødvendige reparationsproteiner på den måde bliver samlet på rette tid og sted i cellen.
Denne teori om, at faseovergange kan resultere i, at materiale samler sig i dråber, er meget attraktiv for adskillige felter indenfor biologi. Det giver nemlig mulighed for at forstå mange forskellige processer som et resultat af, at der via dråbedannelse opstår fordelagtige situationer specifikke steder i cellen, som opløses igen, når der ikke længere er behov for dette respons.
Men hvordan passer dråbedannelsen ind i billedet, hvis cellen får flere skader på sit DNA samtidigt, hvilket meget ofte sker?
Ved at undersøge denne situation ved hjælp af statistisk fysik leder det frem til det resultat, der kaldes Ostwald-modning. Her konkurrerer dråberne om det tilgængelige materiale, men idet der vil strømme mest materiale ind i de største dråber, vil der efter et stykke tid ske det, at alle dråber er forsvundet på nær én, der har samlet al materiale i en monopol-lignende tilstand. Det er en klar udfordring i forhold til at reparere flere DNA-skader, idet den optimale løsning her vil være at fordele materialet, så skaderne kan blive repareret en ad gangen mest effektivt.
Figur 3. Øverst: Skematisk figur, der viser adskillige dråber omkring DNA-skader i cellens kerne. De røde pile angiver dråber, der formindskes, mens de grønne repræsenterer en dråbe, der øges i størrelse.
Nederst: En dråbe om en skade kan optimere reparationen, da proteiner lettere kan finde skaden.
Svingninger bryder monopol-tilstanden
Vi har i vores forskning for nylig vist, at den optimale løsning på dette problem er at igangsætte en svingning i dråbe-materialet, således at det nogle gange kommer under en kritisk værdi, hvor alle dråber opløses.
Man ved, at transkriptionsfaktoren p53 stimulerer syntesen af adskillige proteiner, der er relateret til DNA-reparation, men det har tidligere været uvist, om oscillationer i koncentrationen af p53 faktisk kan øge reparationen af DNA. Her er det interessant, som vi nævnte i indledningen, at koncentrationen af p53 kun begynder at svinge, når der er mange skader på DNA’et (cirka 10 brud på DNA’s dobbeltstreng). Her kan man forestille sig, at cellen ikke har ressourcer til at lave dråber omkring alle steder med brud, men må koncentrere ressourcerne om enkelte steder. På den måde kan en oscillerende koncentration af proteiner give en afgørende tidsskala for, hvornår dråberne opløses og nye skabes gennem tidsrum, der svarer til præcis den tid, det typisk tager at reparere et DNA-brud.
Hvis svingningerne er for langsomme, vil reparationen ikke gå hurtigt nok. Og hvis de går for hurtigt, vil dråberne ikke kunne dannes hurtigt nok, og DNA’et vil ikke blive repareret. Begge situationer kan være fatalt for cellen og måske for hele organismen.
Ud fra klassisk statistisk fysik har vi kunnet forudsige den optimale frekvens, hvormed koncentrationen af p53 skal svinge for at kunne lede til optimal reparation af DNA. Og den teoretiske forudsigelse stemmer overens med de frekvenser, vi observerer i levende celler.
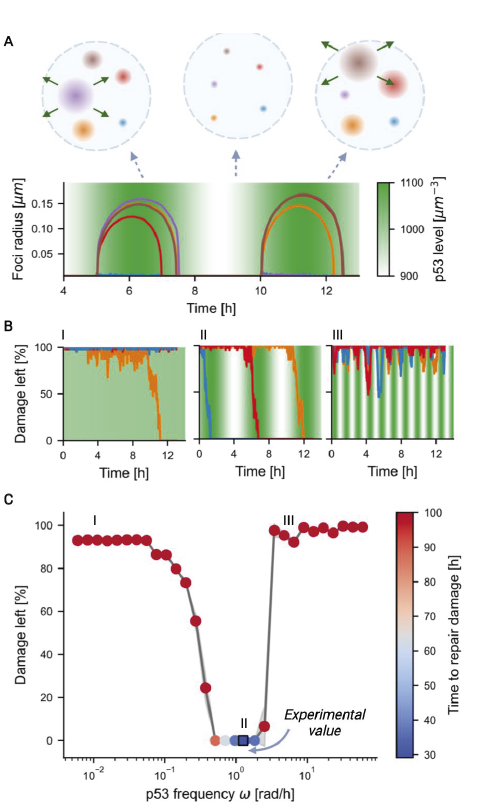
Figur 4. Øverst: Skematisk figur, der viser dannelse og opløsning af dråber under oscillationer.
Oscillationer sørger for, at dråberne kan deles om materialet fremfor, at det alt sammen ender i en enkelt dråbe.
Midt: DNA-skade forsvinder hurtigst med en specifik frekvens, der hverken må være for hurtig eller langsom.
Hvis svingningernes periode er for lang, vil reperationen af DNA-skaderne gå for langsom (venstre), og er perioden for kort, når dråberne ikke at reparere færdigt.
Nederst: Grafen viser reparations-effektiviteten som en funktion af den frekvens, som koncentrationen af p53 svinger med.
Svingninger på et par timer giver den mest optimale reparation.
Svingninger som signal om celledeling?
På nuværende tidspunkt har vi altså vist, at oscillationer i koncentrationen af p53 faktisk effektiviserer reparationen af DNA sammenlignet med, hvis koncentrationen blot havde et konstant niveau. I fremtidige eksperimenter vil vi yderligere teste vores hypotese ved for eksempel at kontrollere længden af perioden for koncentrationssvingningerne af p53 og samtidig måle antallet af ødelagte DNA-områder ved forskellige periodelængder. Her vil vi ud fra teorien forvente, at hvis vi gør perioden for p53-koncentrationen for kort, vil flere DNA-skader ikke blive ordentlig repareret, mens en for lang periode vil forlænge den tid, det tager at reparere alle steder med brud på DNA’et.
I vores forskning vil vi også undersøge, om oscillationerne yderligere fungerer som et afgørende signal, der sikrer, at cellen ikke deler sig så længe, der endnu er skade på DNA'et.
For os er det en meget tiltrækkende tanke, at grundlæggende fysiske principper som svingninger og faseovergange styrer de to mest fundamentale elementer i cellernes respons på DNA-skader: Den direkte reparation og den tilhørende regulering af cellens tilstand (det vil sige, om den for eksempel deler sig eller begår selvmord). Fremtidig forskning vil forhåbentlig kaste yderligere lys over, hvordan dette samspil af mekanismer medvirker til at udføre en af de mest fundamentale opgaver i cellen. ♦