Peptoider: Et bud på fremtidens antibiotika
Traditionel behandling af bakterielle infektionssygdomme med antibiotika nærmer sig sine grænser, fordi bakterier udvikler forsvarsmekanismer. På Roskilde Universitet undersøger en gruppe forskere og specialestuderende en ny klasse af molekyler kaldet peptoider, som blandt andet viser lovende egenskaber som en ny type antibiotika.
Af Biljana Mojsoska.
Infektionssygdomme er ifølge verdenssundhedsorganisationen WHO blandt de 10 hyppigste dødsårsager. Et stigende problem er infektioner, som er resistente overfor lægemidler og derfor er en trussel mod sundhedssystemerne verden over. Specielt kan infektioner være alvorlige for patienter med et kompromitteret immunforsvar såsom patienter med eftervirkninger af Covid-19, cancer, diabetes mv. I næsten et århundrede har brugen af antibiotika været en velpraktiseret strategi og den første forsvarslinje til at bekæmpe bakterielle infektioner. Bakterier er dog yderst tilpasningsdygtige, og som respons på brugen af antibiotika kan de for eksempel danne biofilm, eller de kan udvikle varianter, der er resistente eller tolerante overfor antibiotika og som derfor svækker effektiviteten af disse lægemidler. Som modsvar forsøger vi forskere at isolere nye stoffer fra planter, svampe, bakterier osv., som kan bruges som antibiotika, og udvikle nye metoder til syntetisk at fremstille nye klasser af antibiotika.
Peptoider – en mulig ny klasse af antibiotika
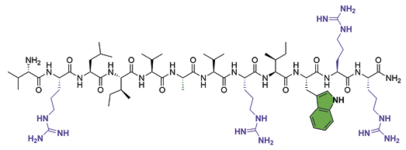
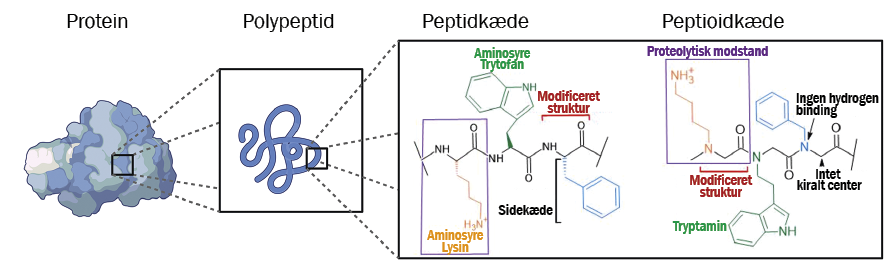
Antimikrobielle peptider er en klasse af antibiotika, der findes i alle levende organismer, og de fungerer som medfødte forsvarsmolekyler for værtsorganismen. Strukturelt set er peptider opbygget ligesom proteiner – det vil sige af strenge af aminosyrer, som er forbundet med peptidbindinger, men disse strenge er i modsætning til proteiner meget korte (typisk 20-50 aminosyrer). De enkelte aminosyrer er opbygget af en amino- og en syregruppe, en kulstofrygrad og sidekæder, og det er de strukturelle komponenter, der ligger bag funktionaliteten af proteinet/peptidet.
Peptider kan have mange forskellige funktioner i organismen, og dem, der er specifikt antimikrobielle, spænder fra 6 op til 40 aminosyrer i længden. Imidlertid er peptider tilbøjelige til at blive nedbrudt af enzymer, og det er en begrænsning for, hvor tilgængelige de kan være i kroppen. For at udnytte de gavnlige antimikrobielle egenskaber ved peptider og samtidig imødegå de strukturelle udfordringer, der gør dem let nedbrydelige, har forskere i det internationale forskningsnetværk Chiron Corporation Team udviklet en ny klasse af peptid-efterligninger kaldte peptoider. De seneste 10 år har der i forskerkredse været en kraftigt stigende interesse for at studere peptoider, og en stor del af disse studier handler om at udnytte deres antimikrobielle egenskaber. Mange forskere ser altså peptoider som en mulig ny klasse af antibiotika.
Udover at peptoider ikke så let bliver nedbrudt af enzymer, har de også lettere ved at trænge ind i bakterieceller, og så er de lettere at syntetisere end antimikrobielle peptider. Alle disse egenskaber gør dem ideelle kandidater for udvikling af ny antibiotika. På Roskilde Universitet arbejder vi i Drug Design & Development lab med at fremstille peptoider ved hjælp af en teknik kaldet submonomer fastfasesyntese, hvor vi sætter funktionelle amin-byggeblokke sammen i en tretrinsproces. Ved at gentage proceduren opbygger vi den ønskede sekvens af amin-byggeblokke.
Sammenlignet med den traditionelle metode til at syntetisere peptider giver denne tilgang os flere muligheder for at bygge amin-sekvenserne ud fra et stort antal tilgængelige aminbiblioteker, hvilket øger sandsynligheden for at lave et molekyle med antibiotiske egenskaber på en tidseffektiv og omkostningseffektiv måde.
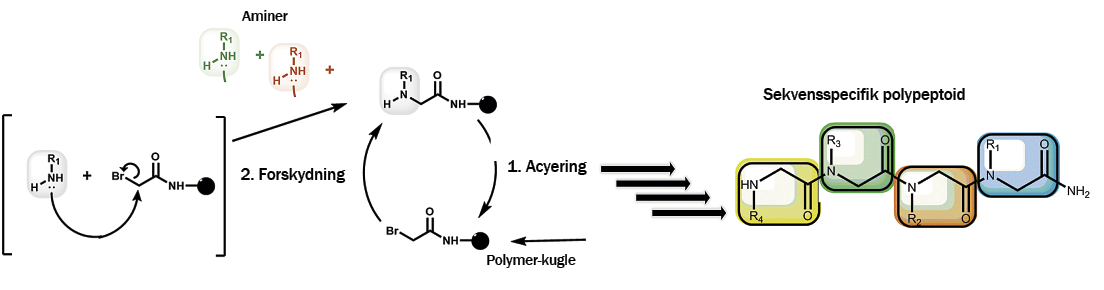
Princippet i fastfase submonomer syntese, som vi arbejder med i laboratoriet på RUC. Som underlag for syntesen bruger vi små kugler af en fast polymer, hvortil vi kan binde adskillige peptoider. De små polymerkugler er meget stabile og reagerer ikke med selv stærke opløsningsmidler, vi kan bruge under syntesen. Selve syntesen af peptoiderne foregår i tre trin.
I det første trin (ikke vist) fjernes en kemisk gruppe, der beskytter en amingruppe koblet til polymerkuglen, og derefter gentages de to næste trin - henholdsvis acylering (1.) og forskydning (2.) – indtil den ønskede sekvens af aminer er opnået.
I trin to acylerer vi en sekundær amin på molekylet (acylering betyder, at der knyttes en funktionel kemisk gruppe af formen RCO til aminen). Til det formål bruger vi bromeddikesyre med N,N-diisopriyl-carbodiimide. I trin tre introduceres en amin med en ønsket funktionalitet, som enten kan være kommercielt tilgængelig, eller som vi selv har syntetiseret i laboratoriet. I dette skridt binder aminen sig til carbonatomet tættest på brom.
Peptoiders vidunderlige egenskaber
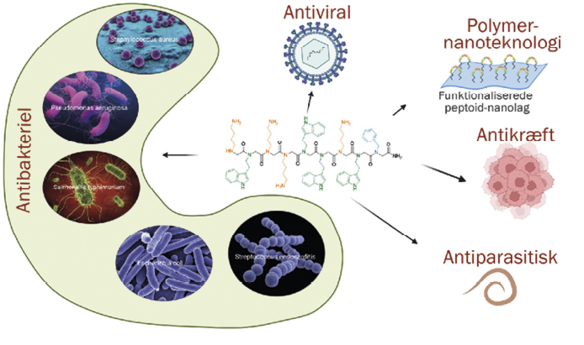
Antiviral
Flere peptoider har i reagensglasforsøg udvist stærk antiviral aktivitet mod både COVID-19 og herpes type 1.
Anticancer
Forskere har identificeret en peptoid dimer, som specifikt er giftig overfor celler, der initierer tumorer i lungecancer. Denne peptoid har dermed potentiale til at kunne blive et lægemiddel mod denne type cancer.
Antiparasitisk
Et studium af en gruppe lineære peptoider fandt, at disse viste lovende aktivitet mod parasitten Leishmania, der forårsager sygdommen Leishmaniasis, der viser sig som kroniske sår på huden.
Nano-biomaterialer
Specifikt designede peptoid-sekvenser kan selvsamle i opløsning og danne robuste nanomaterialer kaldet peptoid-nanolag. Disse nanolag kan bære funktioner, der efterligner forskellige biologiske funktioner, man ser hos proteiner, og vil for eksempel kunne bruges til at genkende antistoffer eller til at neutralisere toksiner.
Sådan dræber peptoider bakterier
Antimikrobielle peptider og peptoider har strukturtræk, der gør det muligt for dem at genkende bakterieceller og gøre væsentlig skade på dem. De er normalt amfifile, hvilket betyder, at de har en hydrofil og hydrofob ende. Deres positive nettoladning gør, at peptider og peptoider kan genkende negativt ladede bakterielle celleoverflader via elektrostatiske vekselvirkninger. Antimikrobielle peptider og peptoider passerer gennem den bakterielle cellemembran ved at destabilisere den igennem forskellige vekselvirkninger, hvilket beskadiger cellemembranen i mange bakterier af den type, der kaldes gram-negative bakterier. Herudover kan denne klasse af molekyler også påvirke gram-positive bakterier på lignende måde, hvor cellemembranen på bakterierne sprænges og ultimativt fører til deres død, eller hvor molekylerne målrettet rammer forskellige processer indeni bakterierne.
I samarbejde med professor Håvard Jenssen ved Roskilde Universitet har vores forskningsgruppe designet og syntetiseret flere peptoidstrukturer, som udviser aktivitet mod multiresistente tuberkulosebakterier (Mycobacterium tuberculosis) og multiresistente Pseudomonas aeruginosa – en bakterie, der kan give infektioner i luft- og urinveje.
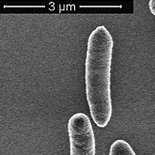

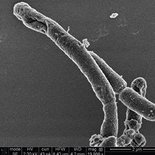
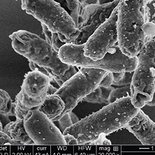
Billeder optaget med scanning elektronmikroskop af E. coli-bakterier – dels ubehandlede (yderst tv.) og dels behandlet med et peptoid med antibakterielle egenskaber. På billederne af bakterier behandlet med peptoid ser man flere morfologiske ændringer af bakterierne, og nogle af bakteriecellerne lækker indhold på grund af sammenbrud af cellemembranens funktion.
Byggesten til nye nanomaterialer
Udover at peptoider har et stort potentiale som antimikrobielle lægemidler, rummer de også et stort potentiale som kemiske byggesten til nye nanomaterialer. Inspireret af, hvordan naturen folder peptider for at danne proteiner, kan vi designe peptoidsekvenser, der er i stand til at samle sig selv til nye nanostrukturer. Når man designer peptoidsekvenserne, så de bærer ladning og hydrofobe egenskaber i en veldefineret position, genkender de hinanden i opløsning og samles i et dobbeltlag, som minder om en cellemembran (en struktur kaldet peptoid-nanolag). Metoden blev oprindeligt udviklet af Ron Zuckermann og hans team på Lawrence Berkeley National Laboratories i Berkely, Californien, hvor forfatteren til denne artikel tilbragte 7 måneder under sine ph.d.-studier.
I 2021 modtog hun en såkaldt Villum Experiment bevilling, der uddeles til forskning, der udfordrer normen og har potentialet til at ændre den måde, vi tilgår vigtige emner på. Bevillingen skal bruges til at designe nye peptoid-sekvenser, som kan bruges til at danne peptoid-nanolag.
Forskningsprojektet vil forsøge at skubbe systemets grænser og undersøge de fysisk-kemiske egenskaber af flere sekvenser med henblik på at bygge peptoid-nanolag, der er funktionaliserede med antimikrobielle peptoider. Perspektivet i denne forskning er, at det på længere sigt kan udmønte sig i nanomaterialer med bakterieafvisende overflader, som kan bruges til medicinsk udstyr, der er i direkte kontakt med kroppen såsom katetre eller kontaktlinser.
Man kan også forestille sig peptoid-nanolag, der kan genkende og neutralisere toksiner eller immun-responsmolekyler i forskellige infektioner (for eksempel interleukiner i COVID-19). Denne ide arbejder vi i forskningsgruppen på i samarbejde med forskere fra Lawrence Berkeley National Laboratories. ♦
Studerende i Drug Design & Development lab
I forskningsgruppen Drug Design & Development lab på RUC arbejder flere studerende med peptoid-design i forbindelse med deres masteruddannelse.
Laura B. Olsson arbejder med et peptoid mærket med farve-stoffet rhodamin, som bruges til at undersøge vekselvirkningen med E. coli-bakterier i realtid ved hjælp af fluorescensmikroskopi.

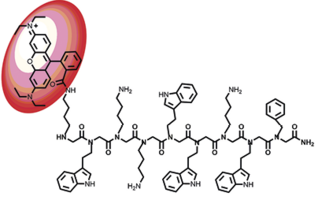
Anna M. Svanholm har i forbindelse med sin masteruddannelse været på ophold på Berkeley National Laboratories for at arbejde med peptoid nanolag ved hjælp af laboratoriets peptid-synthesizer. Til højre ses et billede af peptoid nanolag optaget med atomarkraft-mikroskop (AMF).

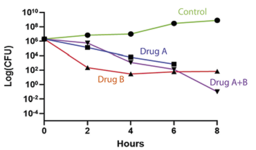
Soffie Pedersen og Jacob Tofte undersøger nye peptoiders potentiale som antibiotika mod bakterielle infektioner og deres effekt på modstandsdygtige (persistente) bakterieceller. Figuren viser et eksempel på ”time kill”-kurver, hvor peptoider er brugt mod bakterien Salmonella typhi (upublicerede data).


Paraschiva C. Irazi arbejder med nye tilgange til at syntetisere et allerede kendt peptid (kaldet IDR-1018), så dette får forbedrede egenskaber i forhold til at bekæmpe både plankton og biofilm.