Forskere afslører cellernes kommandocentraler
I cellerne jonglerer molekylære kommandocentraler rundt med tusindvis af signalmolekyler for at holde cellerne kørende som velsmurte maskiner. Danske forskere har afkodet, hvordan cellens kommandocentraler virker, og hvordan en særlig type dansende proteiner spiller en central rolle i al cellulær kommunikation.
Af Kristian Sjøgren
Hver eneste dag, eneste time, eneste minut og eneste sekund bliver dine celler bombarderet med signaler. Det kan være signaler fra omverden, fra andre steder i kroppen, fra nabocellerne eller fra inde i cellerne selv. Nogle signaler fortæller cellen, at den skal lave flere eller færre proteiner, mens andre fortæller, at den skal ændre den elektriske ladning på cellemembranen. Nogle regulerer temperatur, mens andre styrer celledeling eller reparation af DNA’et.
Med det konstante bombardement af signaler har cellen brug for en mekanisme til at kontrollere, hvordan, hvornår, og i hvilket omfang de forskellige signaler bliver tolket og oversat til handling. Heldigvis er cellerne udstyret med kommandocentraler – såkaldte hub-proteiner – der fungerer ligesom dirigenten i et enormt symfoniorkester, hvor hvert enkelt cellulært signal er et instrument.
Hub-proteinerne vekselvirker med de forskellige signalmolekyler for at lade signalerne blive omsat til handling i cellen. Men ligesom dirigenten er hub-proteinerne ikke ukritiske og lader alle signalmolekyler bestemme takten. Nej, de selekterer meget præcist, hvornår hvert enkelt signal skal omsættes til handling, hvilke signaler der har førsteprioritet, og hvad den videre handling skal bestå af.
»Cellerne bliver hele tiden udsat for en masse signaler, som de skal tage stilling til og reagere på. Det kan være et hormonelt signal, som fortæller cellen, at den skal skrue op for det ene eller andet gen. Det kan være, at cellen producerer for meget syre, så der skal skrues ned for syreproduktion og op for de mekanismer, som fjerner syren. Det kan også være, at saltkoncentrationen uden for cellen eller temperaturen stiger. Så skal cellen reagere på det og lukke ned eller åbne op for forskellige systemer,« fortæller professor Birthe B. Kragelund fra Biologisk Institut ved Københavns Universitet.
Hub-proteiner
Birthe B. Kragelund har i sin forskning gået i dybden med forståelsen af hub-proteinerne, og hvordan funktionen af dem afhænger af de proteiner, som de vekselvirker med.
Ordnede eller uordnede proteiner
Når vi taler om, at hub-proteinerne skal orkestrere signal-symfonien, taler vi om, at de selektivt skal være i stand til at binde til de på ethvert givent tidspunkt vigtigste signalproteiner. Det nytter med andre ord ikke, at cellen får to modsatrettede signaler, eksempelvis at den skal vokse, og at der ikke er næring i omgivelserne, og at hub-proteinerne så forsøger at tvinge cellen til både at vokse og spare på ressourcerne på samme tid.
Dirigenterne skal i stedet være i stand til at filtrere hvert eneste instrument ud i symfoniorkestret og bestemme, om dens tone skal høres eller ej. Er svaret ja, sender hub-proteinet et signal videre til de systemer i cellen, som skal effektuere signalets meddelelse.
Proteiner
Her kommer så det store problem: Forskere har i lang tid kendt til hub-proteinerne, men alligevel har de haft meget svært ved at forstå, hvordan disse kommandocentraler kan være så fintunet selektive, som det er nødvendigt i så delikat et miljø som en celles indre. Hvordan kan de bestemme, om det ene eller andet protein skal binde til hubben, når nu disse signalmolekyler, der skal binde til hubben, ofte er ret ens i den proteinsekvens, som de binder med?
For at kunne besvare det spørgsmål, skal vi rundt om denne histories twist og Birthe B. Kragelunds forskningsmæssige hjertebarn.
Det er nemlig sådan, at hub-proteinerne kan være af to overordnede typer : Ordnede proteiner eller uordnede proteiner.
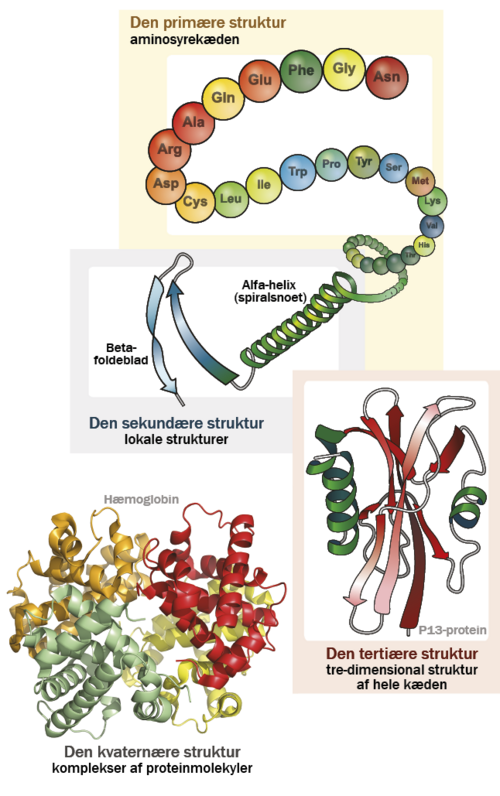
Ordnede proteiner er dem, som de fleste mennesker med en smule indsigt i proteinkemi tænker på, når de tænker på proteiner. Det er proteiner, som gennem kemiske interaktioner er foldet op i en nydelig og fastlagt struktur.
I modsætning hertil er uordnede proteiner dynamiske som livlige, dansende lassoer.
”Hør hov! Dem har jeg aldrig hørt om,” tænker du måske og med god grund.
Først ved kortlægningen af det humane genom ved årtusindeskiftet fik forskere øjnene op for, at proteiner overhovedet kan være uordnede og ikke følge de samme regler som alle andre proteiner. Forskerne blev endnu mere chokerede over at erkende, at svimlende 30 procent af alle proteiner i menneskekroppen faktisk ser ud til at være uordnede. Den erkendelse pillede natten over 100 års lærebogsforståelse af proteiner fra hinanden og igangsatte et helt nyt og banebrydende forskningsfelt, som Birthe B. Kragelund har været en del af lige siden.
Prolaktinreceptoren
Dette forskningsfelt har over årene slået fast, at de uordnede proteiner langt fra er ligegyldige kuriositeter, men spiller afgørende roller for alt fra risikoen for at få kræft til udvikling af neurodegenerative sygdomme som Alzheimers og Parkinsons.
»Vi har erkendt, at ikke alle proteiner opfører sig på samme måde, men at nogle opfører sig markant anderledes, fordi de netop er uordnede. Det giver dem nogle manøvremuligheder, som andre proteiner ikke har. Gennem vores samarbejder fandt vi ud af, at netop hub-proteinerne for manges vedkommende er uordnede, og det er klart, at det må spille en rolle i funktionen og selektiviteten af disse cellulære kommandocentraler,« forklarer Birthe B. Kragelund.
Et samlingspunkt for signaler
Går vi et lag dybere i Birthe B. Kragelunds forskning, kan hub-proteinerne enten være ordnede eller uordnede. De ordnede binder fortrinsvis til uordnede signalmolekyler i form af proteiner, mens de uordnede fortrinsvis binder til ordnede proteiner.
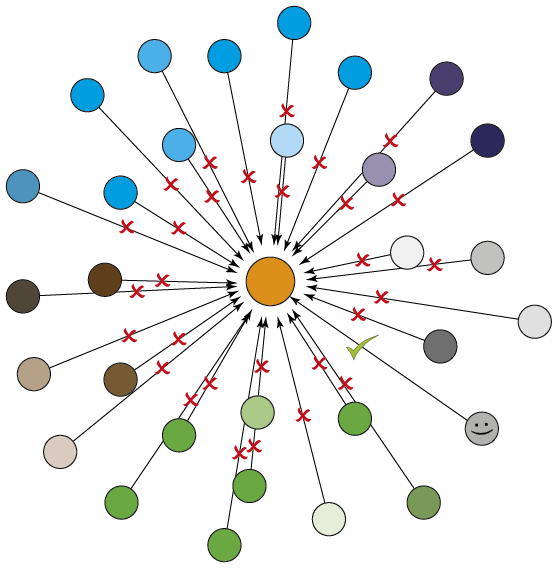
Netop fordi hub-proteinerne kan binde til mere end 30 forskellige bindingspartnere, kalder man dem for hub-proteiner – de er et samlingspunkt for signaler. Hver af disse 30 eller flere forskellige signalmolekyler kommer med en proteinsekvens, som kan genkende en matchende overflade eller lomme på hub-proteinet. Det vil sige, at op imod 30 forskellige proteiner på samme tid slås om at binde til det samme hub-proteins bindingssted og fortælle det, hvilke signaler den skal videreformidle.
»Man kan sige, at alle disse signalproteiner har den samme nøgle til at låse hubben op, men vi har indtil nu langt fra forstået, hvilke betingelser der på et givent tidspunkt tillader den ene nøgle at låse hub-proteinet op og ikke den anden nøgle,« siger Birthe B. Kragelund.
Fakta: Om de uordnede proteiner
Uordnede proteiner adskiller sig fra ordnede proteiner og den måde, som man traditionelt har betragtet struktur og funktion af proteiner på.
Ved kortlægningen af det humane genom omkring år 2000 opdagede forskere, at der i den genetiske kode lå opskrifterne på en masse proteiner, der ikke opfører sig, som proteiner oftest gør. “Normale” proteiner gør det, at de folder sig om sig selv og danner en specifik og forudbestemt struktur med givne funktioner, der ofte er baseret på netop strukturen. Det sker i store træk helt automatisk på basis af forskellige kemiske egenskaber i sekvensen af aminosyrer eller med hjælp fra såkaldte chaperoner.
De uordnede proteiner, som på engelsk kaldes for intrinsically disordered proteins (forkortet IDP), opfører sig ikke på samme måde og indretter sig ikke efter en forudbestemt struktur, men er mere som livlige lassoer, der danser rundt på en tilsyneladende vilkårlig måde. Derfor var den indledende antagelse da også, at disse dansende proteiner umuligt kunne have en funktion – for hvordan kunne de have det uden struktur? Det samme gjaldt specificitet eller bindingsaffinitet.
De seneste 20 års forskning i uordnede proteiner har dog vist, at de sagtens kan indgå i mere eller mindre faste strukturer med andre proteiner, hvilket man eksempelvis ser ved binding mellem hubber og signalmolekyler. I det tilfælde kan dele af det uordnede protein godt folde op i en struktur.
Samtidig er de uordnede proteiner rigtig gode til at vekselvirke med omgivelserne og gør det meget mere end de ordnede proteiner, som ofte blot har én struktur og typisk kan én ting. Man kan sammenligne de ordnede proteiner med en brødkniv. Den er til at skære brød med og kan ikke ændre sig til at blive til en god fiskekniv eller for den sags skyld en hvidløgspresser eller et spækbræt. De uordnede proteiner er derimod som schweizerknive, der kan det ene på det ene tidspunkt og det andet på det andet tidspunkt afhængigt af bindingspartnere og cellens behov.
Forskningen viser også, at i højerestående organismer som os mennesker er omkring 30 procent af vores proteiner multifunktionelle schweizerknive, mens bakterier har langt færre af disse proteiner. Uordnede proteiner ser altså ud til at have spillet en vigtig rolle i udviklingen af komplekst og multicellulært liv.
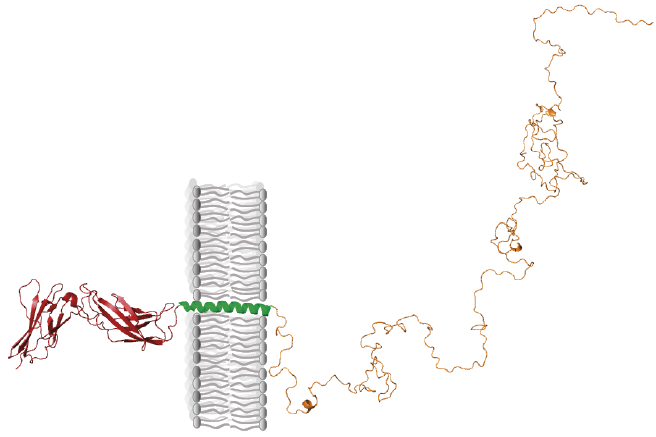
Der er mange velkendte proteiner, som er helt eller delvis uordnede. Det gælder blandt andet histon-proteiner. Disse proteiner er vigtige for organiseringen af DNA’et, og de har lange ustrukturerede dele. De proteiner, som står for hele oversættelsen af DNA til protein, blandt andet transkriptionsfaktorer og polymeraser, er også for en stor dels vedkommende uordnede. Det samme er væksthormonreceptoren, som har ustrukturerede dele. Ligeså prolaktinreceptoren, der er vigtigt for udvikling af brystvæv og mælkeproduktion i forbindelse med graviditet og efter fødslen. Endelig skyldes mange kræftformer mutationer i netop uordnede proteiner.
Skal vi komplicere historien en smule mere, kan man yderligere opdele hub-proteinerne i forskellige grupper. Der findes blandt andet date-hubber, som kun tillader ét signalprotein at binde ad gangen, og så findes der party-hubber, der kan binde til mange forskellige proteiner på samme tid. Partyhubberne bringer blandt andet signalmolekylerne sammen i et kompleks, så de forskellige signalmolekyler vekselvirker med hinanden for til sammen at afgøre det endelige signal, som hubben sender videre i systemet. Hubber kan desuden findes forskellige steder i cellen. Nogle flyder rundt i cytoplasmaet, andre befinder sig i cellekernen, mens party-hubber ofte sidder fast i cellemembranen.
Nyt syn på bindingsstyrken
De forskellige hubber spiller forskellige roller i orkestreringen af livet som celle. Blandt andet spiller nogle en rolle i reparation af DNA, andre kordinerer oversættelsen af DNA til protein, og en helt tredje gruppe holder styr på cellens kemiske balancer. Ofte gør hubberne det, at når de binder til et signalmolekyle, ændrer det ved deres binding til eksempelvis DNA’et i cellen. Signalmolekylet kan enten få hubben til at binde tættere til DNA’et og på den måde blokere for, at det bliver repareret, duplikeret eller oversat til protein. Signalmolekylet kan også binde til hubben, så den slipper sit greb på DNA’et, og alle processerne kan få frit lejde. Endelig kan hub-proteiner også binde til selve de proteiner, som udfører alle disse funktioner. Så alt i alt et komplekst system med en iboende balance.
I sin forskning har Birthe B. Kragelund sammen med et interdisciplinært konsortium af fire kolleger haft øjnene og luppen rettet mod blandt andet en hub, som binder til proteiner, der er involveret i reparation af DNA. Mere specifikt binder hubben til proteinerne, så de kan binde til og reparere DNA’et. Proteinet hedder PCNA, og det er et ordnet protein, som kan binde til en lang række uordnede bindingspartnere. Alle PCNA’s bindingspartnere binder til hubben via den stort set samme lille uordnede proteinsekvens, som slås om det samme lille bindingssite. De forskellige proteiner vil have hub-proteinet til at gøre noget forskelligt, og så bliver det meget vigtigt, at hubben forstår at lytte til de rigtige signaler, i forhold til hvad der er bedst for cellen.
Birthe B. Kragelunds konsortiums forskning viser, hvordan hubber, signalproteiner, uordnede- og ordnede proteiner spiller sammen om at løse problemet.

»Vores forskning viser, at det – modsat den traditionelle forståelse af protein-protein-interaktioner – ikke kun drejer sig om styrken af bindingen i bindingssitet. Egenskaberne i den uordnede kæde uden for bindingssitet har faktisk endnu større betydning for, om det ene eller det andet protein får lov til at binde sig til hubben og fortælle den, hvad den skal gøre. Vi har simpelthen været for snævre i vores syn på, hvad der bestemmer bindingsstyrke i hubber,« forklarer Birthe B. Kragelund.
I det uordnede protein uden for bindingssitet kan der ifølge Birthe B. Kragelunds forskning ligge en masse egenskaber, som afgør, hvor stærkt det ene eller andet protein binder til hubben. Elektrostatiske ladninger kan gøre, at det ene protein binder mange tusinde gange stærkere end det andet, og så bestemmer det protein, hvad hubben skal gøre.
Denne erkendelse er helt ny og forklarer, hvordan der kan være forskelle i 30 givne proteiners bindingsaffinitet til samme hub. Det ligger ikke i selve bindingssitet. Der kan godt være små forskelle i bindingssitet, men de store forskelle ligger ofte uden for bindingsstedet, og der er der stor variation i de uordnede proteiner.
»Hvis mange positive ladninger gør, at man som signalprotein kan binde stærkt til hubben, og man kommer med en masse negative ladninger, så kan det være lige meget, om man kommer med den helt rette og optimale centrale proteinsekvens til at binde til hubbens bindingssite. Så kommer man ikke til at fortælle hubben, hvad den skal gøre,« siger Birthe B. Kragelund. Kan lede til bedre lægemidler Opdagelsen af hubbernes funktionalitet har både grundforskningsmæssige og praktiske implikationer.
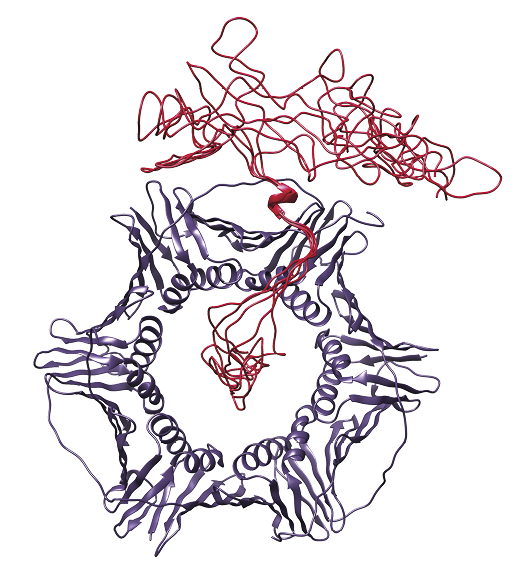
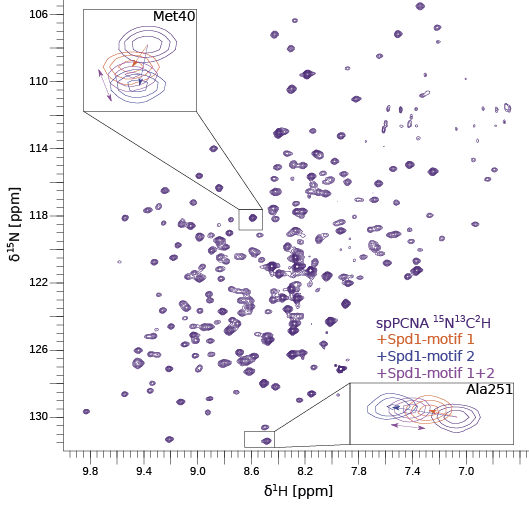
Som vi kan se, ligger signalet for de enkelte motiver på hver side af det signal, vi ser, når begge motiver er til stede. Det fortæller os, at begge motiver binder i konkurrence, men at de binder med en dynamik, der tillader konstant udskiftning mellem dem. For at kunne optage NMR-spektrene, er proteinet mærket med både 15N og 2H (og 13C). (upublicerede data).
På det praktiske plan kan opdagelsen give lægemiddeludviklere endnu et greb af hive fat i, når de vil udvikle bedre lægemidler i fremtiden. Forestil dig, at du som lægemiddeludvikler gerne vil lave et aktivt stof, som binder til og hæmmer et protein, der er involveret i udvikling af sygdom. Her kan du udvikle et lægemiddelstof, som har det rette bindingssite, men det vil altid skulle konkurrere med andre proteiner om at få lov til at binde til netop det bindingssite. I det tilfælde kommer affinitet uden for bindingsstedet til at spille en stor rolle, og kan du udvikle et protein, som ikke bare har den rigtige proteinsekvens til at binde til det specifikke hub-protein inde i cellen, men derudover også kan øge dit lægemiddels affinitet flere tusinde gange i området uden for bindingssitet, kan du få et meget mere potent lægemiddel, som du også skal bruge meget mindre af for at få en effekt.
»I et af vores forsøg har vi øget et lille peptids affinitet 40.000 gange ved at ændre lidt på ladningsforskellen uden for bindingssitet. Det kan gøre en stor forskel, hvis vi taler om udvikling af lægemidler,« siger Birthe B. Kragelund.
Det andet perspektiv i erkendelsen er af grundvidenskabelig karakter – som selvfølgelig også kan vise sig af få betydning for lægemiddelvidenskaben på den lange bane.
Hubberne repræsenterer et netværk af kommunikationscentraler, som orkestrerer et enormt komplekst system for at holde cellen kørende. Hvis man blot ændrer en lille smule på det system, kan tingene falde fra hinanden, og med den indsigt, som Birthe B. Kragelund og hendes konsortium har bragt på bordet, får forskere nu en bedre forståelse af, hvordan tingene kan gå galt.
Lad os lave den antagelse, at vi i et forsøg med nogle celler gerne vil hæmme en given proces for at se, hvad der så kommer til at ske med cellen. Vi kan selvfølgelig hæmme det signalmolekyle, som fortæller hubben, hvordan den skal tolke signalet. Problemet er dog, at signalmolekyler kan binde til mange forskellige hubber, og så mister vi hurtigt overblikket over, hvilke processer vi egentlig hæmmer.
En anden mulighed er at hæmme hubben, men så påvirker vi også mange forskellige processer, da hubberne sjældent kun regulerer én cellulær funktion, men flere.
»30 forskellige bindingspartnere kan repræsentere 30 forskellige processer, men vi vil kun hæmme én. Hvordan gør vi det, hvis vi ikke forstår, hvordan de er forskellige i deres binding? Derfor er det nødvendigt, at vi ikke som tidligere kun kigger på, hvor hub-proteiner og bindingspartnere er ens, men hvor de er forskellige, og det er ikke i bindingssitet, men udenfor. Normalt er vi forskere drevet af at finde mønstre i det, som vi studerer, men lige akkurat i tilfældet med hubberne og de uordnede proteiner skal vi i stedet til at kigge på det, som ikke er et umiddelbart mønster, og prøve at forstå det,« forklarer Birthe B. Kragelund.
Større forståelse af molekylær kommunikation
I forskningen har Birthe B. Kragelund sammen med sine kollegaer benyttet en lang række forskellige analyseteknikker til at kortlægge struktur og funktion af hubber og bindingspartnere. Blandt tusindvis af hubber har de udvalgt tre, som de har kortlagt strukturen af, både når de er bundet til bindingspartnere, og når de ikke er.
Den ene af hubberne er en uordnet partyhub i membranen, mens de to andre er ordnede date-hubber, som binder til uordnede proteiner.
Ved at kende til strukturerne, hvilket vil sige både de tredimensionelle former, samt sekvenserne af de uordnede proteiner, kunne forskerne med brug af komplicerede computeralgoritmer afgøre, hvordan orden og uorden bidrager til diversitet og pålidelighed i hub-bindingspartner-interaktionerne, så der ikke sker miskommunikation i cellen.
»Det er en dybere forståelse af, hvad molekylær kommunikation i cellerne egentlig er, og hvordan det koordineres med orden og uorden i proteinerne,« siger Birthe B. Kragelund. ♦