Livets oprindelse i en RNA-verden
Liv er overalt på jorden; lige fra mørke undersøiske grotter til himlen over hovedet på os. Men hvordan er det opstået? Nye metoder og resultater puster liv i gamle teorier om, hvordan RNA-molekyler kan have haft en nøglerolle i livets opståen.
Af Emil Laust Kristoffersen, Niels Rysgaard Sørensen og Ebbe Andersen
Spørgsmålet om, hvordan livet er opstået på vores planet, har til alle tider optaget mennesket, og det har udmøntet sig i et væld af skabelsesmyter. Gennem de seneste 300 år har naturvidenskaben i stigende grad givet os indblik i, hvordan dette kunne være sket, blandt andet gennem studier af jordens sten og mineraler og ikke mindst deres alder. Den forskning har vist, at Jorden opstod for hele 4,6 milliarder år siden, sandsynligvis efter et sammenstød af kosmiske proportioner. Den tidlige jord og dens søsterplanet, Theia, spiralerede ind i hinanden og lavede i sammenstødet den planet, vi bor på samt vores måne.
De første millioner af år efter Theia-kollisionen var Jorden et ildsprudlende helvedeslandskab med bombardementer af meteoritter, der bragte nye kemiske stoffer til Jorden. Men med tiden kølede planeten stille og roligt ned, hvilket tillod dannelsen af oceaner og søer, og heri var der opløste salte og andre kemiske stoffer. I denne “ursuppe” forestiller man sig, at livet opstod ud fra kemiske byggesten for mere end 3,8 milliarder år siden. Geologer finder nemlig flere og flere klare tegn på, at livet i form af simple livsformer fra det tidspunkt og frem var vidt udbredt på jorden.
Men hvad satte gang i livets udvikling?
Livets kemi i en ursuppe
Tilbage i 1950’erne undrede forskerne Stanley Miller og Harold Urey sig over livets kemi. Som gode kemikere lavede de et eksperiment med kolber, bunsenbrændere og elektriske udladninger for at simulere det fysiske miljø på den tidlige jord med varmekilder, lynnedslag osv. Ved at cirkulere simple kemiske stoffer igennem deres system kunne de vise, at nogle af livets vigtigste byggesten såsom aminosyrer og DNA-baser kunne dannes ud fra disse simple komponenter.
Senere forskning er kommet frem til lignende resultater, og i dag ved man, at nukleotiderne, byggestenene i DNA og RNA, kan opstå under såkaldt “præbiotiske” forhold, altså i en verden uden liv.
Tilstedeværelsen af livets kemi er dog ikke lig med liv! For at nå dertil skal nukleotider eller aminosyrer sættes sammen til kæder, der har komplekse kemiske funktioner. Det er sådan, livet fungerer i dag: Informationsbærende kæder af DNA afskrives til kæder af RNA, der oversættes til funktionelle kæder af proteiner, som udfører livets reaktioner. Men hvordan kan disse kæder opstå, og hvilket molekyle opstod først: DNA, RNA eller protein?
Om RNA-molekylet
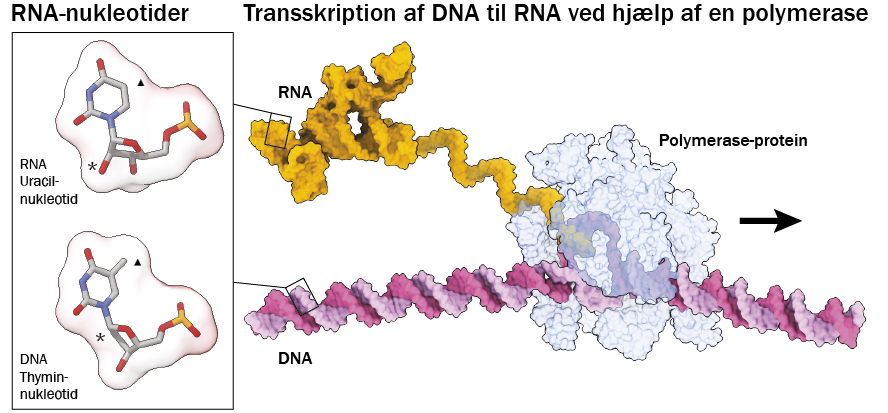
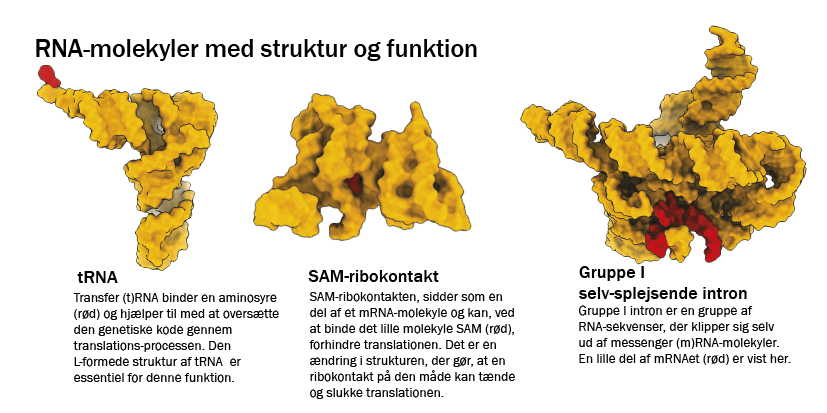
RNA-molekylet er kun lidt forskelligt fra sin fætter DNA. RNA har et ekstra oxygenatom på sin sukker-del og en uracil-base i stedet for en thymin-base. Til forskel fra DNA, der bliver kopieret af DNA-polymerase som lange dobbeltstrenge, bliver RNA kopieret af RNA-polymerase som lange enkelt-strenge, der kan base-parre med sig selv og danne interne foldninger. RNA kan danne komplekse strukturer, der har egenskaber i lighed med enzymer – kaldet ribozymer. I visse tilfælde kan RNA-molekyler også skifte form, når det binder til et andet molekyle, eller når dets fysiske betingelser ændrer sig (en såkaldt ribokontakt). Det gør det let at tænde og slukke for RNA-aktiviteter.
Skjulte spor af en RNA-verden
Ved at gå på opdagelse i den grundlæggende molekylærbiologi kan vi som detektiver finde spor efter RNA’s rolle i livets oprindelse. RNA har oprindeligt været en smule undervurderet i molekylærbiologien, da dets rolle har været set som messenger (budbringer) mellem DNA og protein. Men da man i 1980’erne blev i stand til at undersøge RNA’s funktion nærmere, viste der sig en mere grundlæggende rolle. RNA kan nemlig både indeholde genetisk information (ligesom DNA) og udføre kemiske reaktioner (ligesom proteiner), og RNA kunne derfor muligvis være selve nøglen til livets oprindelse (se faktaboks om RNA-molekylet).
Det første spor, der peger i den retning, finder vi i molekylærbiologiens centrale dogme, der handler om, hvordan cellen får den genetiske kode i DNA oversat til funktionelle proteiner med RNA som messenger. Her viser det sig, at ribosomet, den molekylære maskine, der klarer oversættelsen fra messenger-RNA til protein, er dannet af to store RNA-molekyler. Dermed er ribosomet faktisk en RNA-maskine, der laver proteiner. Det faktum tyder på, at RNA kom før proteiner og måske endda, at RNA “opfandt” proteinerne. Ud over ribosomet findes der også andre katalytisk aktive RNA-molekyler. Tilsammen kaldes de aktive RNA-molekyler for ribozymer.
Det andet spor, der peger på en nøglerolle for RNA i livets oprindelse, finder vi i byggestenene for RNA. RNA bruges både som cellens centrale energi-molekyle (ATP) og som udgangspunkt for at danne byggestenene til DNA. RNA-byggesten bliver modificeret af et protein-enzym via en kompliceret kemisk proces for at danne DNA-byggesten. Det tyder på, at RNA og proteiner kom før DNA.
Men denne logik har også problemer. For DNA og RNA bliver i cellerne kopieret af polymerase-proteiner, hvilket antyder at proteiner kom først. Vi er derfor endt i et problem svarende til, om det er hønen eller ægget, der kom først.
Løsningen på dette “hønen eller ægget-problem” kan være et katalytisk aktivt RNA, der kan kopiere RNA – et såkaldt RNA-polymerase-ribozym (eller en RNA-kopimaskine). Med sådan en kopimaskine kan proteiner og DNA nemlig helt undværes. Ideen om, at RNA kan kopiere RNA, er central for hypotesen om, at livet opstod i en såkaldt “RNA-verden”. Ideen opstod første gang allerede i 1950’erne, efter at James Watson og Francis Crick havde opdaget strukturen af DNA, men blev først rigtig udbredt i 1980’erne, da man opdagede ribozymerne. Hypotesen om en RNA-verden postulerer, at livets oprindelse startede med RNA, og derefter opfandt DNA og protein.
Som ovenfor beskrevet ved vi, at ribosomet kan danne proteiner, men kan et ribozym også danne RNA? Det er et godt spørgsmål, for ingen har hidtil fundet en sådan RNA-baseret RNA-kopimaskine i naturen. Men det udelukker ikke, at den har eksisteret en gang.
Jagten på den forsvundne RNA-kopimaskine
Tilhængere af RNA-verden-hypotesen lod sig ikke stoppe af den manglende RNA-kopimaskine – for det kan jo være, at den har eksisteret tidligere i livets historie, men er blevet udkonkurreret af de mere effektive polymerase-proteiner. Ligesom de store dinosaurer kan RNA-baseret liv tænkes at have fundet sit endeligt på et tidspunkt i Jordens lange historie i den skarpe konkurrence med andre livsformer.
I 1990'erne satte forskerne David Bartel og Jack Szostak sig for at udvikle en RNA-kopimaskine i laboratoriet. De brugte “kunstig evolution” til at udvikle et RNA-molekyle med helt nye egenskaber (se faktaboksen på næste side). Til deres store overraskelse fiskede de et ribozym ud af deres eksperiment, der kunne sætte to RNA-molekyler sammen. De viste dermed, at RNA kan udføre den reaktion, som skal til for at bygge RNA-kæder. Og de sandsynliggjorde samtidig, at en RNA-kopimaskine kunne have eksisteret.
Siden dette gennembrud er ribozymet blevet videreudviklet i forskellige laboratorier verden over for at gøre det mere og mere effektivt til at kopiere RNA. En interessant udvikling skete i 2018, hvor Philipp Holliger, James Attwater og andre ved Cambridge University i England fik RNA-kopimaskinen til at kopiere lange RNA-strenge. I deres udviklingsforsøg brugte de større byggesten (tri-nukleotider), der gjorde processen mere effektiv. Og så satte de RNA-kopimaskinen i fryseren, hvilket førte til opkoncentrering og stabilisering af kopierings-processen.
Under forsøgene blev RNA-kopimaskinen bedre og bedre, men så skete noget uventet. RNA-kopimaskinen blev pludselig dobbelt så stor. Det viste sig, at den havde “kapret” en misfoldet version af sig selv, og overraskende nok var dette dobbelte RNA-polymerase-ribozym nu endnu mere effektivt. Man kan sige, at der skete en form for “symbiose”, da et samarbejde opstod mellem to RNA-molekyler, der gjorde dem begge mere effektive. Forskerne viste, at RNA-polymerase-ribozymet kunne producere kopier af sig selv, og på den måde så de første selv-kopierende RNA-kopimaskiner dagens lys.
Kryogen elektronmikroskopi
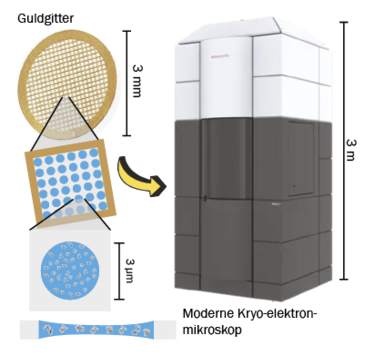
Kryogen elektronmikroskopi er en populær metode til at bestemme den 3-dimensionelle struktur af biomolekyler. Metoden fungerer ved, at en prøve af biomolekyler dryppes på et gitter og hurtigfryses til meget lave temperaturer (-200 °C). På den måde opnår man, at biomolekylerne fanges i en gennemsigtig is. I mikroskopet skydes elektroner på prøven, og de afbøjes, når de rammer biomolekylerne. Derved får man et billede, der er mørkt, hvor biomolekylerne har afbøjet elektronerne, og lysere hvor der kun er is.
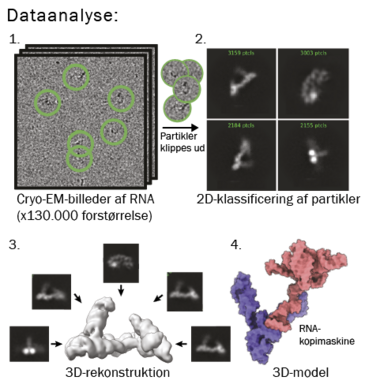
Nu tager man tusindvis af billeder, som analyseres med en computer, hvor molekylerne bliver identificeret i isen som små mørke partikler (se trin 1). Disse partikler bliver klippet ud og klassificeret i 2D ud fra de forskellige orienteringer af partiklerne (trin 2). Man skal gerne have mange partikler i alle de forskellige orienteringer, som molekylet kan have, og til denne proces skal man bruge tusindvis af partikler set fra alle retninger. Efterhånden som 2D-klassificeringen forløber, ser man sit molekyle bedre og bedre. Til sidst bestemmes den 3-dimensionelle struktur ud fra de forskellige orienteringer i 2D (trin 3). Under optimale betingelser kan man med denne teknik se de enkelte atomer i biomolekylet og bygge en atomar model (trin 4).
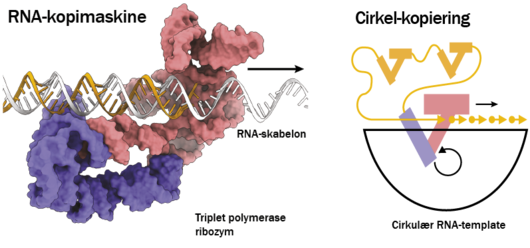
Vi har brugt denne teknik til at bestemme strukturen af RNA-kopimaskinen, der her vises som rød og lilla (nederst til højre). Den lilla enhed repræsenterer den støtte-enhed, der som støtter funktionen af den røde enhed, som er ribozymet. Sammen gør de reaktionen mere effektiv. Det er i den røde enhed, at den katalytiske kerne findes – altså den, som giver ribozymet sin funktion og gør det i stand til at kopiere RNA.
RNA-kopimaskinen under mikroskopet
For at få en dybere forståelse af RNA-kopimaskinen har vi studeret den med såkaldt kryo-elektronmikroskopi (se faktaboks). Det skete som et samarbejde mellem Philipp Holligers gruppe i Cambridge og Ebbe Andersens gruppe på Aarhus Universitet. Ud fra mikroskopibillederne kunne vi rekonstruere en 3D-model af RNA-polymerase-ribozymet, hvilket gav os et unikt indblik i, hvordan det var sammensat og virkede.
Overordnet har ribozymet form som en hånd og ligner dermed protein-baserede polymeraser. Vi kunne også observere, hvordan de to enheder af ribozymet sidder sammen og forklare, hvordan de tilsammen understøtter, at den RNA-streng, der skal kopieres, placeres og bindes i reaktionscenteret. Denne opbygning ser man også i visse polymerase-proteiner og forklarer, hvorfor samarbejdet mellem to enheder gør ribozymet bedre.
Vores 3D-model afslørede også RNA-kopimaskinens “korrekturlæsnings"-domæne, som er med til at sikre, at der ikke opstår fejl under kopieringsprocessen. Strukturen forklarede, hvordan dette domæne genkender de nye tri-nukleotider og sørger for, at de bliver indbygget i RNA-kopien på den rette måde.
Ved at koble 3D-modellen med mutationsdata kunne vi se, præcis hvilke områder der var vigtige for kopieringen og dermed opstille en mere præcis model for, hvordan RNA-kopimaskinen fungerer.
En fascinerende opdagelse ved dette var, at et RNA-molekyle, der er udviklet i et reagensglas, har adopteret så mange egenskaber som også findes i naturligt udviklede protein-baserede polymeraser.
Gennem kunstig evolution har forskere altså lavet en RNA-kopimaskine og vist, at RNA besidder de funktioner, der skal til for at gøre RNA-verdenen mulig. Vores forskning har bidraget til dette og kastet lys over de underliggende processer, der giver kopimaskinen sin funktionelle struktur. Men – for der er et stort men – den nuværende RNA-kopimaskine er ikke i stand til at kopiere sig selv effektivt nok til, at vi kan hævde, at RNA-verdenshypotesen er bekræftet.
Godt nok kan kopimaskinen kopiere sig selv, men den er så dårlig til det, at det svarer til, at alle mennesker i Danmark tilsammen kun kunne producere ét barn. Det er klart, at den effektivitet er ikke bæredygtig, og med tiden vil populationen bukke under. Vi skal derfor have effektiviteten op med mere end tusind gange, før vi endegyldigt kan sige, at RNA-kopimaskiner kunne have udgjort livets oprindelse.
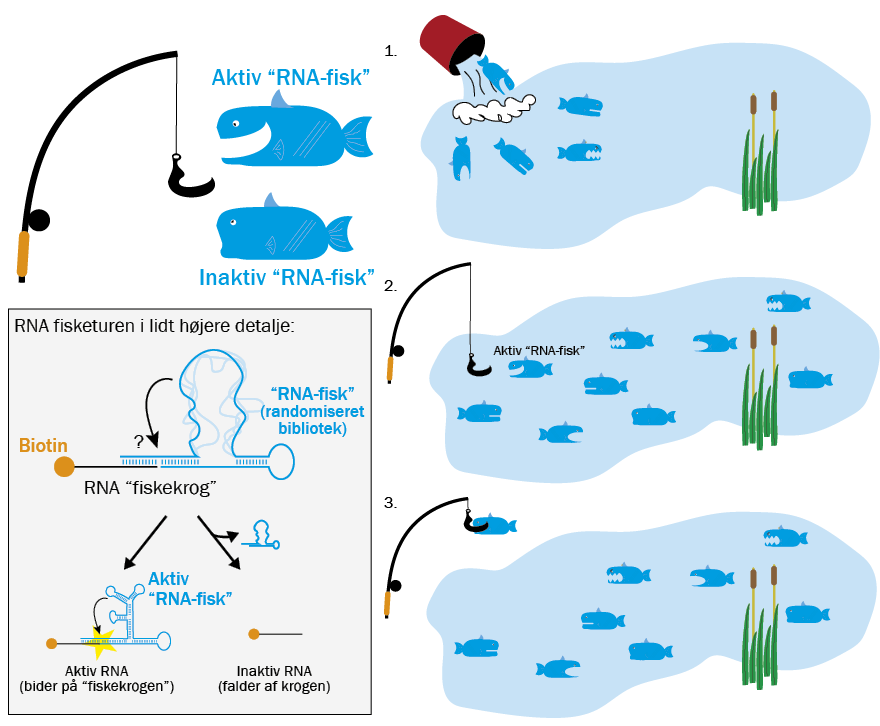
Kunstig evolution – udvikling af funktionelle RNA-molekyler
En vigtig metode til at udvikle molekyler med nye egenskaber i laboratoriet kaldes kunstig evolution. Denne metode kan sammenlignes med en molekylær fisketur – i denne sammenhæng i en sø fyldt med RNA-fisk. I praksis er søen med RNA-fisk et enormt bibliotek af forskellige RNA-sekvenser. I Bartel og Szostaks eksperiment med at udvikle en RNA-kopimaskine tilbage i 1990’erne var disse RNA-sekvenser op til 220 baser lange, og de bestod af helt tilfældige baser.
Det skabte en helt enorm mulighed for variation i sekvenserne (husk på, at der er fire forskellige baser, der kan sidde på hver plads, så en 220 baser lang sekvens giver altså 4220 mulige kombinationer). Spørgsmålet var, om der fandtes et aktivt RNA-molekyle i biblioteket, som kunne overleve Bartel og Szostak’s kunstige evolution.
Konkret søgte Bartel og Szostak efter RNA, der kan sætte RNA-molekyler sammen, og de fremstillede derfor en ׅ“RNA-fiskekrog”, der binder sig til de aktive RNA-sekvenser i søen, der har netop den egenskab.
Når en RNA-fisk på den måde bed på krogen, kunne Bartel og Szostak undersøge dens RNA-sekvens, og de kunne også kopiere RNA-molekylet og indføre nye mutationer for derved at lave et nyt bibliotek, der indeholdt variationer af den oprindelige RNA-sekvens. Ved at gentage denne fiskeproces mange gange selekterede Bartel og Szostak hver runde for de “RNA-fisk”, der var bedst til at bide på krogen. I processen blev Bartel og Szostaks RNA-molekyler en milliard gange bedre til at sætte sig på krogen, inden de stoppede.
Selv hvis der i starten kun havde været ét RNA-molekyle i hele bibliotekets milliarder af sekvenser, der bare besad en smule aktivitet, kan man med fisketur-strategien fange og udvikle de funktionelle RNA-sekvenser, så de bliver bedre og bedre. Til sidst vil man, hvis man har lavet sine forsøg ordentligt, stå med et effektivt ribozym, der er specialiseret til den proces, man har selekteret for.
Som allerede nævnt er der et helt enormt antal mulige RNA-sekvenser. En kun 10 baser lang sekvens har således 1.048.576 mulige kombinationer, og i biblioteker større end cirka 50 baser er det ikke praktisk muligt at have alle de mulige sekvenser. Ved 150 baser skulle man i så fald bruge alle atomer i hele universet. Alligevel blev den oprindelige RNA-kopimaskine (på 220 baser, som har 10132 mulige sekvenser) fundet i et bibliotek, hvis praktiske størrelse kun var på cirka 1015 forskellige sekvenser, altså en lille bitte fraktion af de mulige sekvenser. Men alligevel hev Bartel og Szostak en RNA-kopimaskine ud.
Det tyder på, at RNA-kopimaskine-funktionen slet ikke er så sjælden, som man kunne tro, og det siger derfor også noget om sandsynligheden for, at sådanne molekyler kunne opstå i en RNA-verden.
Arbejder på at gøre RNA-kopimaskinen mere effektiv
Nogle vil måske hævde, at RNA, der kan kopiere sig selv, ikke er levende. Men som vi har argumenteret ovenfor, indeholder et sådant selv-kopierende system et af de vigtigste elementer for liv, nemlig at det kan udvikle sig evolutionært.
Hvad skal der ellers til for at danne et levende system? Her kan vi blive inspireret af NASA’s definition af liv som “et selv-opretholdt kemisk system i stand til darwinistisk evolution”, som fortæller os, at livet ud over at skulle kunne udvikle sig evolutionært også skal være selvopretholdende.
For at nå dertil kræves, at RNA-kopimaskinen bliver effektiv nok til, at hver RNA-kopimaskine laver mindst én funktionel kopi af sig selv. For først i det tilfælde vil der kunne opretholdes en stabil population af kopimaskiner, som evolutionen kan “virke på”.
Denne udfordring kan måske overkommes ved at udvikle yderligere på RNA-kopimaskinen i laboratoriet. I Emil L. Kristoffersens forskningsgruppe på Aarhus Universitet arbejder forskerne netop med at gøre det, hvor viden om virus’ simple kopieringsstrategier udnyttes til at øge effektiviteten. Hvis dette lykkes, og et sådant system fodres med RNA-nukleotider bygget af præbiotisk, kemiske synteseveje, vil en RNA-kopimaskine både være selvopretholdende og have evnen til at udvikle sig evolutionært (og derved kunne siges at være levende).
Til venstre ses RNA-kopimaskinen (rød og lilla), som kan forlænge en RNA-streng (gul) på en RNA-skabelon (hvid). Pilen indikerer den retning, som RNA-kopimaskinen er ved at forlænge den gule streng.
I fremtiden kan kopimaskinen måske blive så aktiv, at den kan lave flere af sig selv gennem en proces, der hedder rullende cirkel-kopiering (til højre), og som er kendt fra simple vira. I illustrationen er RNA-kopimaskinen (rød og lilla) ved at forlænge en streng (gul) på en cirkulær RNA-skabelon-streng (sort). På en lineær skabelon-streng vil kopimaskinen stoppe, når den kommer til enden af strengen og falde af. Men på en cirkel vil den kunne fortsætte rundt og rundt og få cirklen til at rulle. RNA-kopimaskinen vil da kunne køre flere omgange omkring cirklen. Hvis RNA-kopimaskinen er kodet i cirklen, vil flere og flere af disse dannes i den forlængede streng og kan i princippet hjælpe med til kopieringen af sig selv.
Kan vi skabe liv i laboratoriet?
For at danne et selvopretholdende kemisk system, som ligner livet, som vi kender det i dag, er det dog ikke nok med en RNA-kopimaskine.
Man skal også danne en celle med en metabolisme, som kan dele sig til nye celler. Men hvornår opstod cellen? Var det før eller efter livet? Eller er cellens opståen lig med livets opståen?
Flere forskningsgrupper over hele verden arbejder med den teori, at livet opstod sammen med cellen. For at kunne besvare dette spørgsmål forsøger de at efterligne cellulære processer og metabolisme ved at bygge dem fra bunden. En stor udfordring i den forbindelse er at få de enkelte cellulære elementer integreret i ét system, som derved kan kaldes levende. Denne forskning kan være med til at afdække, hvor komplekst et system der skal til for i sin tid at starte livet, og hvor mange komponenter af eksisterende biologi, man er nødt til at genopfinde for at kunne genopfinde livet i laboratoriet.
Vi vil slutte med at gentage, at videnskaben stadig ikke har afdækket, hvordan livet er opstået på Jorden. Men RNA-verdenshypotesen giver et godt bud på, hvordan præbiotisk kemi kan have lavet RNA-kæder, der kunne kopiere sig selv og derved danne det første selvopretholdende evolutionære system.
Men da dette originale liv desværre er forsvundet, må vi studere de betingelser, dette RNA-baserede liv kan være opstået under ved at forsøge at genskabe det fra bunden. Det første trin er RNA-kopimaskinen, næste en celle og til sidst – muligvis – en hel RNA-baseret organisme, hvor kopiering og metabolisme varetages udelukkende af RNA-molekyler hjulpet på vej af kemiske forbindelser, der optages fra omgivelserne. Hvis vi lykkes med det, kan det vise en vej til, hvordan RNA-verdenen har ført til liv.
Præbiotisk kemi og RNA-verdner på andre planeter vil i så fald måske have givet det samme udfald. Og måske er livet slet ikke så unikt, som vi går og tror? ♦