RNA-teknologi: Det næste kvantespring i udviklingen af lægemidler
Pandemien med COVID-19 bragte for alvor RNA i fokus som en ny og potent platform til at lave vacciner og lægemidler. Nu står teknologien på spring til at revolutionere behandlingen af en lang række sygdomme, som vi i dag ikke kan gøre noget ved.
Før 2019 havde de færreste hørt om mRNA-teknologi. Endnu færre havde forestillet sig, at de fleste af os inden for et par år ville blive vaccineret med vacciner, som var lavet med mRNA-teknologi. Med COVID-19-pandemien lærte vi dog alle sammen at sige coronavirus, og gennem vaccinerne fra blandt andet Moderna og Pfizer-BioNTech kom vi også til at lære begrebet mRNA at kende.
Selvom de fleste af os først har hørt om mRNA-vaccineteknologi for relativ nylig, er det ikke et nyt fænomen indenfor forskning i lægemidler. Forskning i RNA-teknologi i en lægemiddelsammenhæng har allerede kastet et par Nobelpriser af sig, og i omkring 20 år har forskere forsøgt at udvikle teknologien til ikke bare at lave vacciner mod coronavirus, men også til at kurere en lang række sygdomme fra leversygdomme og muskelsygdomme til Parkinsons sygdom og lungesygdomme.
I dag findes der 18 RNA-lægemidler på markedet, hvoraf de fleste er målrettet sygdomme i leveren. Men med succeserne fra pandemien står endnu flere lægemiddelproducenter på spring for at udvikle ny, potent og banebrydende medicin, der kan tage hånd om sygdomme, som vi i dag har meget svært ved at gøre noget ved.
En af de forskere, der har dedikeret en stor del af sin forskningskarriere til forskning i RNA-teknologi i en lægemiddelsammenhæng, er professor Jørgen Kjems fra Institut for Molekylærbiologi og Genetik ved Aarhus Universitet.
»RNA-teknologi har været mange år undervejs, og vi har ofte haft store forventninger til teknologien for derefter at blive skuffede, fordi vi er stødt på problemer, som har fået os til næsten at opgive. Men i lyset af det, som er sket indenfor de seneste år, tror jeg ikke, at vi kommer til at opgive denne gang. Nu er de rette forhold for teknologien til stede, og jeg forventer, at RNA-teknologi kommer til at være et paradigmeskifte indenfor lægemiddeludvikling i fremtiden,« siger Jørgen Kjems.
COVID-19 satte mRNA-teknologi på verdenskortet
Når vi taler om RNA-teknologi i en lægemiddelsammenhæng, taler vi faktisk om forskellige teknologier, hvor stykker af RNA kan ændre på vores biologi og derved forhindre eller behandle sygdom.
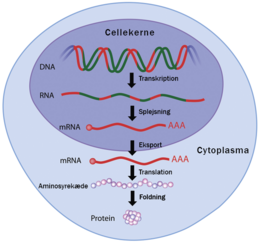
Den i dag mest kendte teknologi er den, som er baseret på mRNA. Indenfor vaccineudvikling benytter lægemiddel-producenter det faktum, at alle vores celler har nogle fundamentale mekanismer, som oversætter vores arvemasse i form af DNA via mRNA til proteiner. Det vil sige, at når cellerne skal udtrykke et gen, bliver der fra vores DNA dannet en unik mRNA-streng, som fungerer som en slags blueprint til at lave et givent protein.
I vaccinerne mod coronavirus puttede lægemiddelproducenterne Moderna og Pfizer-BioNTech mRNA for coronavirussets spikeprotein ind i vaccinerne. Efter vaccinerne blev skudt ind i vores muskler, tog vores cellulære maskiner fat i mRNA’et, som var det kroppens eget mRNA, og lavede store mængder spikeproteiner, som i sig selv ikke er farlige, fordi resten af coronavirus ikke fulgte med. Kroppens immunforsvar lærte på den måde spikeproteinet at kende og var derfor klar til at gå til modangreb, når coronavirus senere smittede os.
»mRNA-teknologi fungerer som en slags speeder i kroppens celler og er i stand til at øge produktionen af relevante proteiner. Indenfor vaccineudvikling kan det være virusproteiner, som man kan lære kroppen af genkende. På grund af succeserne med vaccinerne mod coronavirus forsøger vaccineproducenter i dag at lave vacciner mod andre sygdomme, herunder influenza og andre virus- eller bakteriesygdomme, men også kræft,« forklarer Jørgen Kjems.
Små stykker RNA er potent medicin
En anden af de meget interessante RNA-teknologier er baseret på såkaldt “RNA antisense-teknologi”. Den type RNA fungerer meget anderledes end mRNA, idet RNA’et ved antisense hæmmer produktionen af specifikke proteiner, som er fremmende for sygdom, for eksempel kræftsygdom.
Antisenseteknologien fungerer på den måde, at et komplementært stykke RNA binder til mRNA’et og derved forhindrer produktionen af givne proteiner. På den måde skal forskere “blot” designe stykker af RNA, som matcher RNA’et på de stykker mRNA, som de vil regulere funktionen af. I en lægemiddelsammenhæng er denne egenskab meget interessant, idet mange sygdomme er kendetegnet ved netop overproduktion af givne proteiner.
De første forsøg med antisense-RNA til behandling af sygdomme var dog en stor skuffelse, fordi teknologien virkede rigtig godt på papiret, men i den virkelige verden ikke havde den samme potente effekt, som forskerne havde forventet og håbet på.
En udfordring at få RNA ind i cellerne
Et af de problemer, som forskere skal løse, hvis de vil gøre RNA-medicin til en stor del af fremtidens lægemidler, er, at celler naturligt nedbryder de stoffer, som trænger ind i dem. Årsagen er den, at cellerne sjældent skal bruge stofferne i deres helhed, men bare de individuelle komponenter enkeltvist.
Når et molekyle – eller et stykke RNA – bliver genkendt af et overfladeprotein, danner cellemembranen et såkaldt endosom, der er som en afsnøring af et stykke af cellemembranen. Inde i den cellemembran ligger det molekyle, som nu er indkapslet i endosomet inde i cellens cytoplasma.
Endosomet fusionerer på et tidspunkt med et såkaldt lysosom, der har den ene funktion, at det nedbryder store molekyler til deres bestanddele. Det vil for vores medicinske stykke RNA betyde, at hvis det ikke kommer ud af endosomet, inden endosomet fusionerer med lysosomet, bliver RNA’et nedbrudt, inden det overhovedet kan nå at have en effekt.
Forskere arbejdet intenst på at udvikle metoder, som kan hjælpe RNA’et ud af endosomet og ud i cytoplasmaet, hvor det enten kan booste eller bremse produktionen af givne proteiner. Blandt andet prøver forskere at udvikle metoder til at sprænge endosomerne med et osmotisk tryk, som bliver skabt af kemiske grupper, som opsuger protonerne. Forskere kigger også i retning af virus og bakterier, som for manges vedkommende har udviklet metoder til at trænge ud af endosomerne, så de kan overtage cellerne indefra.
En anden mulighed er at udnytte kroppens egne molekyler som trojanske heste. Når celler skal kommunikere med hinanden, gør de det med blandt andet med miceller, også kaldet ekstracellulære vesikler, der modsat endosomerne eksporteres ud af cellen for at bevæge sig frit rundt i blodet og andre kropsvæsker. Når en ekstracellulær vesikel møder en celle, sammensmelter de med cellemembranen og tømmer indholdet af vesiklen ind i cytoplasmaet, uden at det kommer i karambolage med lysosomerne. Derudover har ekstracellulære vesikler en evne til at genkende specifikke celletyper, specielt syge celler som er inflammatoriske. Det gør dem interessante i forhold til at målrette lægemidler til for eksempel led med gigt og forkalkninger i årene.
Det store gennembrud kom i 1998, hvor forskerne Andrew Fire and Craig Mello opdagede fænomenet “RNA-interferens”, der er en ny metode til at hæmme mRNA på, og som de fik Nobelprisen for i 2006. De to forskere viste, at hvis antisense-RNA bliver leveret til cellerne i dobbeltstrenget form, virker de meget mere effektivt. Dog var der det problem, at dobbeltstrenget RNA er giftigt for vores celler.
Det problem blev løst i 2003, hvor den tyske professor Thomas Tuschl fandt ud af, at hvis man laver det dobbeltstrengede RNA ultrakort, er det ugiftigt for celler, men bibeholder evnen til at nedregulere produktionen af proteiner. Faktisk skal det dobbeltstrengede RNA ikke være mere end 21 nukleotider langt (der er omkring tre milliarder i menneskets arvemasse), for at det fungerer rigtig godt. Denne type RNA fik navnet “small interferring RNA” eller siRNA.
»Man kan betragte mRNA som speederen i forhold til produktionen af proteiner og siRNA som bremsen. Forskellige sygdomme skal behandles ved enten at skrue op eller ned for proteinproduktionen, og her kan hver teknologi få sin anvendelse afhængigt af sygdommen. Det smarte ved siRNA er også, at det kopierer nogle mekanismer, som findes i cellerne i forvejen, og som cellerne benytter til at regulere produktionen af proteiner. Denne regulering består af såkaldt mikroRNA, der også i udgangspunktet er dobbeltstrenget. Derfor virker det også bedre, når vi i udviklingen af lægemidler benytter dobbeltstrenget siRNA fremfor enkeltstrenget RNA,« forklarer Jørgen Kjems.
Endelig er der også den mulighed, at man med antisense-teknologi kan modulere effekten af kroppens eget mikroRNA. Idet mikroRNA i sig selv fungerer som en bremse for mRNA, vil en blokering af effekten af mikroRNA være som at trykke yderligere på speederen i forhold til produktionen af proteiner ud fra det givne mRNA.
Nanopartikler beskytter RNA i kroppen
Nuvel, det hele virker måske “helt simpelt” og “ligetil”, og sådan havde forskerne det også i årene efter 2003. Optimismen og troen på fremtiden for RNA-medicin var stor, men omkring år 2010 faldt korthuset sammen, og alle optimisterne måtte erkende, at det ikke var så simpelt at lave RNA-medicin, som de havde troet. Problemet var meget enkelt, at når forskerne sendte deres nøje designede RNA-stykker ind i kroppen, fandt de ud af, at kroppens enzymer i blodet hurtigt nedbrød dem, inden de overhovedet kunne nå at have nogen effekt.
»Der var behov for en løsning til at beskytte RNA’et inde i kroppen, og dertil udviklede man lipid-nano-partikler, som er små nanopakker, der kan beskytte RNA’et på dets rejse rundt i kroppen. Lipid-nano-partikler var også årsagen til, at det med pandemiens ankomst overhovedet var muligt at lave mRNA-vacciner mod coronavirus. Ellers ville kroppens celler bare ødelægge mRNA’et for spikeproteinet, inden det overhovedet kom ind i cellerne og blev oversat fra RNA til protein,« forklarer Jørgen Kjems.
Lipid-nano-partiklerne fungerer på den måde, at de beskytter RNA’et, mens det flyder rundt mellem cellerne. På et tidspunkt smelter de dog sammen med cellemembranen og tømmer indholdet, hvilket vil sige RNA’et, ind i cellerne.
»Den store udfordring for os forskere er lige nu og her, at vi skal have vores RNA det rigtige sted hen i kroppen. Hvis vi bare sprøjter vores lipid-nanopartikler ind i blodet, ender det meste i blodets “skraldespand”, leveren. Alle de RNA-baserede lægemidler, som er på markedet i dag, er da også målrettet sygdomme i leveren, men vi vil gerne kunne målrette RNA-medicin til andre steder i kroppen, for eksempel hjernen,« forklarer Jørgen Kjems.
Cirkulært RNA kan gøre lægemiddeleffekten endnu mere potent

I Jørgen Kjems laboratorium undersøger forskerne muligheden for at benytte cirkulært RNA til at skabe en lægemiddeleffekt i kroppens celler. Et af problemerne omkring RNA-medicin er nemlig, at lineært RNA er meget sårbart og hurtigt bliver klippet i stykker af cellernes nedbrydningsmekanismer, som tager fat i RNA’et og klipper det op fra enderne. Det problem overkommer cirkulært RNA, og der findes også i naturen cirkulært RNA, som blandt andet binder til mikroRNA og bremser deres regulering af mRNA.
Det interessante ved cirkulært RNA er, at det kan opretholde lægemiddelfunktionen i meget længere tid. Kigger man som eksempel på de vacciner, som Moderna og Pfizer-BioNTech har udviklet, så overlever mRNA’et i dem kun i få timer i kroppens celler. Derefter producerer cellerne ikke mere af spikeproteinet. Det er nok, for at kroppen kan beskytte sig mod coronavirus.
Men i behandling af sygdomme, hvor et defekt protein skal erstattes, kan det være mere interessant at opretholde produktionen i længere tid for at undgå gentagne behandlinger med kort mellemrum. Her bliver cirkulært RNA rigtig interessant.
Udvikling af vacciner og genetablering af defekte proteiner med cirkulært RNA er blandt de store forskningsområder, som Jørgen Kjems og hans forskningsgruppe arbejder med.
Man kan også forestille sig, at man kan sprøjte RNA-medicinen på overfladen af celler, for eksempel i næsen, munden eller lungerne, og ad den vej lade dem trænge ind der, hvor de skal have en effekt. Denne tilgang kan især være interessant indenfor behandling af lungesygdomme, hvor man kan forestille sig, at man indånder RNA-medicin, som kan trænge ind i lungecellerne og enten stoppe produktionen af problematiske proteiner med siRNA eller erstatte defekte gener med mRNA. Denne tilgang er som eksempel interessant ved behandling af cystisk fibrose, som netop skyldes et defekt gen.
»Vi arbejder selv på en række projekter med det formål at kunne levere siRNA til behandling af lunger og har fundet ud af, at man ved at indkapsle siRNA i en skal bestående af kulhydratet chitosan fra rejeskaller opnår fordelagtige egenskaber i forhold til at få siRNA ind i lungeceller gennem luftvejene,« siger Jørgen Kjems.
Svært at målrette RNA til de relevante celler i kroppen
Forskere prøver på forskellige måder at få lipid-nano-partikler indeholdende RNA til at ramme celler rundt om i kroppen, så teknologien kan benyttes til andet end bare behandling af leversygdomme. En af måderne at gøre det på er ved at sætte ligander på overfladen af lipid-nano-partikler, så de binder til proteiner på overfladen af bestemte celler. Alle kroppens celler er udstyret med unikke proteiner på overfladen, og derved er det muligt at designe ligander, som binder lipid-nano-partikler til for eksempel immunforsvarets celler eller sågar kræftceller og leverer sin last af RNA der. Forskere forsøger også at lave RNA-lægemidler, der via ligander kan trænge over blod-hjerne-barrieren og derved være målrettet celler i hjernen.
»Blandt andet er Parkinsons sygdom kendetegnet ved en overproduktion af givne proteiner. Her er det tanken, at man med siRNA kan sætte en bremse på produktionen af disse proteiner og derved bremse udviklingen af sygdommen. Det kræver dog, at vi kan få vores siRNA frem til de rette celler i hjernen,« siger Jørgen Kjems.
En helt tredje mulighed, som forskere har haft succes med, er at undgå lipid-nano-partiklerne og i stedet sætte ligander direkte på siRNA’et, hvilket dog kræver, at siRNAet er beskyttet mod nedbrydning med kemiske modifikationer.
Figuren viser princippet i at bruge syntetisk dobbeltstrenget RNA (siRNA) til at forhindre produktionen af specifikke proteiner i kroppen (den øverst del af figuren). Metoden er effektiv, da ét dobbeltstrenget RNA kan slukke for produktionen af mange proteiner. Det smarte er, at metoden efterligner en naturlig mekanisme (vist nederst på figuren), der hæmmer produktionen af proteiner.
Findes allerede RNA-lægemidler mod flere sygdomme
Kigger vi på de områder, hvor forskere og lægemiddelproducenter lige nu er længst fremme i forhold til at udnytte RNA-medicin til at kurere sygdomme, springer leversygdomme som sagt i øjnene.
I 2018 kom det første lægemiddel på markedet til behandling af sygdommen transthyretin amyloidose, som er en sygdom, hvor kroppens organer, herunder leveren, aflejrer en masse proteiner i organet. Det får langsomt leveren til at bryde sammen. Sygdommen er arvelig, men kan med et lægemiddel baseret på siRNA (partisiran) kureres. Partisiran går meget simpelt ind og sætter en stopper for produktionen af de problematiske proteiner, og efter 10 til 14 dage er mængden i leveren og andre organer reduceret med 80 %.
På samme måde har medicinalfirmaer også udviklet og fået godkendt siRNA-baseret medicin til behandling af leversygdommene akut hepatisk porfyri, metabolisk acidose og primær hyperkolesterolæmi.
Endelig er der også lægemidlet Spinraza, der er kendt som værende et af verdens dyreste lægemidler med en pris på 750.000 kr. per behandling. Spinraza, som ganske vist ikke er siRNA-teknologi, men baseret på det oprindelige antisense-princip, er designet til behandling af muskelsvindsygdommen spinal muskelatrofi.
Muskelatrofi skyldes, at et mRNA ikke bliver modnet korrekt, og derved bliver der ikke produceret et essentielt protein for normal muskeludvikling. Problemet er, at en mutation i genet medfører at proteinsyntesen stopper midt i produktionsforløbet. Spinraza virker ved at omdirigere modningen af mRNA’et, så proteinproduktionen delvis genetableres.
»Man får ganske vist ikke et perfekt protein ud af det, men man får et protein, som kan fungere,« fortæller Jørgen Kjems.
Vil lave vacciner mod kræft
Skeler vi til mRNA-teknologien, er forskere interesseret i at bruge teknologien til blandt andet vaccineudvikling. Her er det oplagt at bruge vaccinen mod andre virussygdomme som influenza, men der er også stor interesse inden for udvikling af mRNA-vacciner mod blandt andet HPV-virus, der kan være kræftfremkaldende. Faktisk forestiller forskere sig, at det er muligt at bruge mRNA-vacciner til at beskytte direkte mod kræften i sig selv. Her er det tanken, at alle kræftceller udtrykker unikke proteiner på overfladen. Disse proteiner findes ikke på overfladen af andre celler i kroppen, og kan man få immunforsvaret til at genkende og gå til angreb på celler med disse proteiner på overfladen, vil man være beskyttet mod kræft.
»Ligesom man med vaccinerne til beskyttelse mod COVID-19 lærer immunforsvaret at gå til angreb på spikeproteiner, kan man med vacciner med mRNA formentlig lære immunforsvaret at gå til angreb på kræftceller. Der forskes rigtig meget i den type vacciner, og det bliver interessant at se, hvad der kommer ud af det,« siger Jørgen Kjems.
mRNA-teknologien kan også benyttes indenfor behandling af sygdomme, hvor kroppen ikke producerer givne proteiner. Her kan man med mRNA-teknologi introducere de manglende cellulære blueprints, så cellerne selv kan producere de proteiner, som de mangler.
»Her er den store interesse fortsat indenfor leversygdomme, men også inden for metaboliske sygdomme som diabetes og behandling af svær overvægt. RNA-teknologi rummer et enormt potentiale, idet der praktisk talt ikke findes den sygdom, hvor problemet ikke drejer sig om for høj eller lav produktion af forskellige proteiner. En anden af de helt store fordele ved RNA-teknologi er også, at vi kan ramme mål inde i cellerne. De fleste lægemidler er i dag målrettet proteiner på overfladen af cellerne, men med RNA-teknologi kan vi i princippet ramme alle proteiner, og det giver helt nye behandlingsmuligheder,« siger Jørgen Kjems. ♦